Réaction du fer avec les acides

Page 1 / 4
Réaction du fer avec les acides
Quels matériaux utilisons-nous pour emballer les liquides ? les matériaux réagissent-ils avec les
solutions aqueuses acides ou basiques ? comment décaper les métaux ?
1. Attaque du fer par les acides
Les boissons sont conditionnées en canettes d'aluminium ou d'acier (99% de fer). Or, un test de conduction
électrique montre que celles en acier sont recouvertes d'un vernis protecteur car elles ne conduisent pas le
courant. Étudions le pourquoi de cette protection en attaquant du fer avec plusieurs acides.
1.1 les transformations chimiques:
Tube 1 Tube 2 Tube 3
de la laine de fer en
petite quantité + acide
chlorhydrique
de la laine de fer en
grande quantité + acide
chlorhydrique
de la laine de fer en petite
quantité + acide
sulfurique
après quelques moment
d'attente.... dégagement gazeux important dégagement
gazeux dégagement gazeux
au bout de quelques temps
....
Il n'y a plus de laine de
fer
. Si l'on rajoute d'autres
brins, la réaction
précédente recommence.
Il reste de la laine de fer
mais il n'y a plus de
dégagement gazeux. Si on
rajoute un peu d'acide
(acide chlorhydrique ou
sulfurique) le dégagement
reprend.
Il n'y a plus de laine de
fer.
Que reste - il des réactifs
?....
Tout le fer solide a
disparu, il reste de l'acide
dans le tube.
Tout l'acide a disparu , il
reste du fer solide dans le
tube.
Tout le fer solide a
disparu, il reste de l'acide
dans le tube.
conclusion: Dans chaque cas, c'est l'ion hydrogène H
+
, commun aux deux acides, qui réagit avec le métal. Si
l'acide est en excès, c'est le métal qui disparaît totalement. Si c'est le métal qui est en excès, c'est l'acide qui
disparaît totalement.
1.2 Identification des produits de la transformation chimique
1.2.1 quelle est la nature du gaz apparu ?
réfléchissons... La solution aqueuse d'acide contient: des ions hydrogène H
+
, des ions chlorure Cl
-
et des
molécules d'eau ( molécules formées d'atomes d'oxygène et d'hydrogène), le métal fer est un empilement
ordonné d'atomes de fer. Les gaz possibles qui peuvent se former après réarrangement des atomes à partir des
réactifs peuvent être: du dioxygène(O
2
), du dihydrogène(H
2
), du dichlore(Cl
2
).
test du dioxygène test du dichlore test du dihydrogène
test négatif: la bûchette au bout
incandescent ne se ravive pas
test négatif: le papier imbibé
d'iodure de potassium ne noircit pas
test positif: on obtient le "pop" ou
"aboiement" qui caractérise la
présence du dihydrogène.H
2

Page 2 / 4
1.2.2 où sont passés les atomes de fer ?
réfléchissons... Le fer solide a disparu, le fer est dans la solution, les atomes ont perdus des électrons et sont
devenus des ions.
Manipulation: On verse quelques gouttes d'hydroxyde de sodium (soude) dans la solution restante après
l'attaque de l'acide. Il se forme un précipité vert foncé .
ion réactif résultat identification ion
ion hydroxyde OH
-
précipité vert foncé ion fer II (ou ion
ferreux) Fe
2+
1.2.3 où sont passés les atomes de chlore et les molécules d'eau ?
Manipulation: On verse quelques gouttes de nitrate d'argent dans la solution restante après l'attaque de l'acide..
Il se forme un précipité blanc de chlorure d'argent qui peu à peu noircit à la lumière.
ion réactif résultat identification ion
ion argent Ag
+
précipité blanc qui noircit
à la lumière chlorure Cl
-
Manipulation: on verse quelques gouttes de la solution restante après l'attaque de l'acide, le sulfate de cuivre
anhydre bleuit.
Nous admettrons que les ions chlorure et les molécules d'eau sont dans les mêmes proportions qu'au
départ de la réaction.
1.2.3 tableau récapitulatif des corps formés ou restants après les transformations chimiques
Tests test de l'aboiement test à la soude test au nitrate
d'argent test au sulfate de
cuivre
corps identifiés
dihydrogène (gaz)
H
2
nouveau corps: produit
ions ferreux
(en solution) Fe
2+
nouveau corps: produit
ions chlorure
(en solution) molécules d'eau
(en solution)
La solution aqueuse obtenue est une solution de chlorure de fer II. La solution est électriquement neutre, il faut
que le nombre total de charges positives soit égal au nombre total de charges négatives et ceci sans modifier
la formule des ions !
.... La formule est: Fe
2+
+ 2 Cl
-

Page 3 / 4
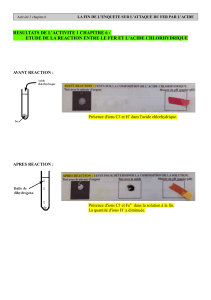
2. Bilan des transformations chimiques de l'attaque du fer par l'acide chlorhydrique
On utilise le modèle de la réaction chimique à l'état macroscopique en faisant le bilan avant réaction et après
réaction.
2.1 Inventaire des réactifs et des produits
corps avant réaction: les réactifs corps après réaction : les produits
•
acide chlorhydrique (H
+
+ Cl
-
): ions hydrogène
H
+
, ions chlorure Cl
-
et molécules d'eau (H
2
O).
•
fer sous forme solide: atomes de fer (Fe)
•
Dihydrogène gazeux : molécules H
2
•
Solution de chlorure de fer II (Fe
2+
+ 2 Cl
-
):
ions chlorure Cl
-
, ions ferreux Fe
2+
et
molécules d'eau (H
2
O).
réfléchissons..
•
Le fer solide a disparu, le fer est dans la solution, les atomes ont perdus des électrons et sont devenus
des ions ferreux :
1 atome de fer 1 ion fer II + 2 électrons ( Fe Fe
2+
+ 2 e
-
)
•
Comme les électrons ne peuvent être seuls en solution, ce sont les ions hydrogène de l'acide qui ont
captés ces électrons pour devenir des atomes d'hydrogène. D'ailleurs en fin de réaction ces ions ont
disparus :
1 ion hydrogène + 1 électron un atome d' hydrogène ( H
+
+ e
-
H )
Deux atomes d'hydrogène s'associent pour former une molécule de dihydrogène. ( H + H
H
2
)
2.2 Écriture de l'équation chimique
principe pour "ajuster" les nombres stœchiométriques d' une équation chimique: les équations chimiques
doivent satisfaire trois critères:
•
le nombre et le type d'atomes contenus dans les réactifs se retrouvent dans les produits
•
les nombres stoechiométriques (coefficients multiplicatifs utilisés) sont des nombres entiers (en 3°), les
plus petits possibles.
•
La solution doit être électriquement neutre, le nombre de charges positives est égal au nombre des
charges négatives de chaque coté de la flèche.
Il y a conservation des charges !
Appliquons:.. Équation chimique de l'attaque du métal fer par l'acide chlorhydrique
Réactifs Produits
fer + acide chlorhydrique chlorure de fer II + dihydrogène
Fe + (H
+
+ Cl
-
)
(Fe
2+
+ 2Cl
-
)
+
H
2
"ajustage" des coefficients stoechiométriques par le
bilan des éléments (conservation atomique de
Lavoisier…)
"ajustage" des coefficients stoechiométriques par la
conservation des charges

Page 4 / 4
Fe + (H
+
+ Cl
-
)
(Fe
2+
+ 2Cl
-
)
+
H
2
•
fer: 1 et (hydrogène: 1 avec chlore : 1)
(
fer: 1
avec chlore : 2) et hydrogène: 2
•
l'équation n'est pas "ajustée"; le nombre d'hydrogène doit être le
même des deux côtés de l'équation. soit le nombre 2; on multiplie par
2 dans les réactifs : x 2
•
soit pour les réactifs fer: 1 et 2x (hydrogène: 1 avec chlore :
1) ou encore hydrogène: 2x1=2 , chlore : 2x1 =2
Fe + (H
+
+ Cl
-
)
(Fe
2+
+ 2Cl
-
)
+
H
2
•
nombre de charges positives et négatives dans les réactifs : 1 (1 + et 1
-
)
•
nombre de charges positives et négatives dans les produits : 2 (2+ et
2x1
-
)
•
l'équation n'est pas "ajustée"; le nombre de charges doit être le
même des deux côtés de l'équation. soit le nombre 2; on multiplie par
2 dans les réactifs : x 2
•
soit pour les réactifs 2x(1+ , 1
-
) ou encore 2x1+ =2 + et 2x1
-
Fe + 2 (H
+
+ Cl
-
) (Fe
2+
+ 2Cl
-
)
+
H
2
Fe + 2H
+
+ 2Cl
-
Fe
2+
+ 2Cl
- +
H
2
Les ions chlorure n'interviennent pas dans la réaction même s'ils sont indispensables pour que la solution
soit électriquement neutre. Ce sont les ions "spectateurs". On peut donc simplifier l'écriture de l'équation
en ne les mentionnant pas.
Fe + 2 H
+
Fe
2+
+
H
2
Remarques * :
D’autres métaux comme le Zinc (Zn) ou l’aluminium (Al) réagissent comme le fer avec les acides et libèrent du
dihydrogène.
Exercices : écrire la réaction d’un acide avec le Zinc, puis avec l’Aluminium… (il faut équilibrer les atomes et les charges…)
Mais le Cuivre, il ne réagit pas, on n’observe pas de réaction à court terme. Toutefois, on observe au bout de
quelques jours une coloration bleue de la solution acide…
En connaissant le « pouvoir oxydant » des ions
(
ici l’ion H
+
, très fort dans l’échelle des oxydants :(
=
…
)
, on
peut prévoir les réactions avec les métaux (réducteurs célèbres pour leurs électrons libres…)…Affaire à suivre
dans le chapitre suivant…
1
/
4
100%