Réaction Fer-Acide : Cours de Chimie

L’attaque du fer par les acides
Dans la vie quotidienne, certaines personnes font tremper une pièce métallique qu’ils souhaitent nettoyer dans
du coca-cola. Or nous savons que le coca-cola avec un pH voisin de 3 est acide…
Réaction entre le fer et les acides.
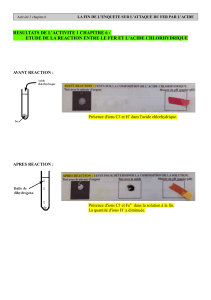
Etude de la réaction
Pour étudier cette réaction, nous allons réaliser deux expériences similaires :
Observation :
Que ce soit avec l’acide chlorhydrique ou que ce soit avec l’acide sulfurique, des bulles de gaz apparaissent au
cours de l’expérience. Après un certain temps, on peut constater que du fer a disparu (il est « rongé »).
Conclusion :
La disparition du fer et l’apparition d’une nouvelle substance sous forme de gaz indique qu’il y transformation
chimique entre le fer et les acides.
Le seul point commun entre les deux acides étant l’ion hydrogène (formule H+), on peut affirmer qu’il y a
réaction chimique entre : le fer et les ions hydrogène des acides.
Analyse de la réaction
Pour bien comprendre ce qu’il se passe, il est nécessaire de réaliser des tests supplémentaires.
Quel est le gaz apparu ?
Observation et conclusion:
le gaz qui se dégage explose avec une détonation caractéristique (une sorte d’aboiement).
C’est du dihydrogène.
fer fer
Acide
chlorhydrique Acide sulfurique
Dégagement gazeux Dégagement gazeux
Fer et acide
Le gaz explose
en faisant un
bruit(comme un
« aboiement »)

Que sont devenus les atomes de fer du métal ?
Utilisons le test de reconnaissance des ions fer pour savoir si les atomes de fer du métal se sont transformés en
ions fer :
Observation :
Un précipité vert se forme si l’on verse de la soude dans le liquide où a eu lieu la réaction entre le fer et l’acide.
Conclusion :
Au cours de la transformation chimique entre le fer et l’acide, les atomes de fer du métal se sont transformés en
ions fer II.
Reste-t-il des ions chlorure de l’acide chlorhydrique ?
Utilisons le test de reconnaissance des ions chlorure :
Observation :
Un précipité blanc se forme si l’on verse du nitrate d’argent dans le liquide où a eu lieu la réaction entre le fer et
l’acide.
Conclusion :
Des ions chlorure sont présents au début de la réaction (dans l’acide chlorhydrique) et à la fin de la réaction
(mis en évidence par le test précédent). Ils n’ont donc pas participé à la transformation chimique entre le fer et
l’acide. Les ions chlorure seront appelés « ions spectateurs ».
Remarque :
Lors de la réaction entre le fer et l’acide sulfurique, ce sont les ions sulfate qui sont spectateurs.
Fer et acide
Hydroxyde de
sodium (ou
soude)
Un précipité vert
apparaît
Fer et acide
Nitrate
d’argent
Un précipité blanc
apparaît
On filtre ce
liquide
suite
suite
On filtre ce
liquide

Bilan et équation bilan de la réaction entre le fer et l’acide chlorhydrique :
Les substances présentes au début la transformation chimique sont :
- le fer, composé d’atomes de fer (formule chimique : Fe)
- l’acide chlorhydrique (formule chimique : H
+
+ Cl
-
)
Les substances présentes à la fin de la transformation sont :
- le gaz dihydrogène, composé de molécules de formule chimique H2
- le liquide qui contient des ions fer II (Fe2+) et des ions chlorure (Cl-) :
on l’appellera « chlorure de fer II »
Bilan :
Fer + acide chlorhydrique → dihydrogène + chlorure de fer II
Equation bilan :
Fe + (H
+
+ Cl
-
) → H
2
+ (Fe
2+
+ Cl
-
)
Cette écriture est provisoire: un liquide est toujours électriquement neutre et l’équation bilan doit respecter la
loi de conservation des atomes.
Fe + 2 (H
+
+ Cl
-
) → H
2
+ (Fe
2+
+ 2 Cl
-
)
Remarque :
L’écriture de cette équation bilan peut être simplifiée en effaçant les ions spectateurs. Cela donne alors :
Fe + 2 H
+
→ H
2
+ Fe
2+
1
/
3
100%