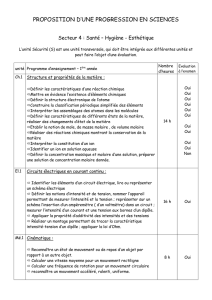
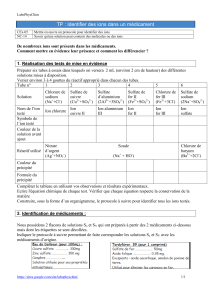
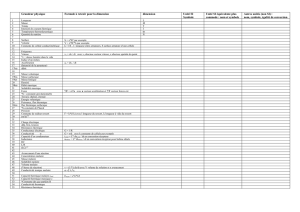
Solutions ioniques

PremièreS TP solutions ioniques concentration et tache complexe.
1. Rappel du formulaire sur les concentrations :
2. Préparation d’une solution titrée
La masse molaire du chlorure de sodium est M=Cl 35,5+Na23 g/mol.
On souhaite préparer un volume de 50 mL de sérum physiologique de concentration 9g/L.
1. Calculer la masse nécessaire.
2. Retrouver le lien entre la concentration massique et la concentration
molaire du soluté.
3. Exemple d’application : Le coca cola contient 106g/L de sucre
saccharose de masse molaire 342 g/mol calculer la concentration
molaire.
Préparation de la solution. consignes orales
Un moyen de contrôler une concentration : le conductimètre.
Cette méthode mesure le courant électrique du au déplacement des ions dans la solution. Pour des
solutions diluées la valeur mesurée est proportionnelle à la concentration.
4. Mesurer la conductivité de la solution que vous avez préparé.
5. Mesurer la conductivité de l’eau du robinet.
6. L’eau du robinet contient-elle des ions ?
7. Une eau sans ion est-elle possible ?
3. Partie théorique. Tache complexe
Le cristal de sel.
Observer le cristal microscopique les ions sont rangés régulièrement.
La masse volumique du sel est 2,17g/cm3.
8. Quelle est la distance entre deux atomes de sel dans le solide ?
Solution aqueuse de chlorure de sodium.
Dissolution : le cristal est attaqué par les molécules d’eau.
Solvatation : l’eau, molécule polaire enrobe chaque ion, en présentant le signe
opposé.
On dessine un ion Na+ et un Ion Cl- solvatés.
Deuxième série de questions :
9. Dans la solution de sérum physiologique quelle est la distance entre deux ions ?
10. Dans cette solution, combien ya t-il de molécules d’eau pour un ion du sel ?
11. Estimer alors le nombre de molécules d’eau entre deux ions.

PremièreS TP solutions ioniques concentration et tache complexe.
4. Conductivité mesures suite
1. Mesurer la conductivité de l’eau du robinet, de l’eau déminéralisée.
2. Conclure, l’eau du robinet contient-elle des ions ?
3. Conclure quand à la pureté de l’eau déminéralisée.
4. Etablir un protocole pour préparer une solution de saccharose de concentration molaire 100
millimole/L.
5. Comment savoir si la solution de saccharose est ionique ou pas ?
6. Conclure : le saccharose est-il un solide ionique ou moléculaire ?
7. Pourquoi de l’eau déminéralisée est nécessaire ?
8. Pour éliminer le rôle du solvant on souhaite comparer avec une solution de sel (chlorure de
sodium)
9. Proposer un protocole, en précisant bien les paramètres choisis.
1
/
2
100%