TP Effets thermiques Co

Partie SPORT Ch11 Réaction chimique
La dissolution d’un composé ionique dans l’eau s’accompagne-t-elle toujours d’un effet de froid comme dans les
poches pour soigner les sportifs
1) Protocole :
On réalise différents mélanges de solutions ioniques et on mesure la température du liquide avant mélange puis après
mélange. Si la température augmente, la réaction sera exothermique, si elle diminue elle sera endothermique, si elle
reste constante, on dit qu’elle est athermique.
2) Schéma
3) Tableau de résultats
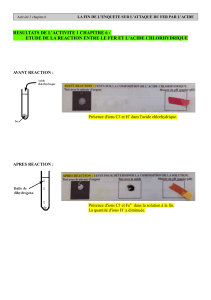
B. Réaction entre le fer et un acide (Manipulation professeur !)
On fait réagir de l’acide chlorhydrique sur du fer. Il apparait une effervescence, donc signe de dégagement gazeux.
La solution prend une coloration verte.
1) Les deux espèces chimiques qui apparaissent au cours de la transformation chimique de l’acide chlorhydrique sur le
fer sont le dihydrogène H2, mis en évidence par la détonation de l’allumette, et les ions fer Fe 2+
2) Les deux tests ayant permis d’identifier ces espèces pour le dihydrogène H2, on approche une allumette enflammée, il
se produit une détonation au niveau du tube à essai. Pour les ions Fe 2+, on ajoute de l’hydroxyde de sodium (Na++OH- ou
soude), il se produit un précipité verdâtre.
3) Donner l’état initial et l’état final de ce système chimique.
Etat initial : Fer, solide, et Acide chlorhydrique H++Cl– liquide.
Etat final : Le fer a disparu, il reste de l’acide chlorhydrique et il s’est formé du dihydrogène H2 et des ions Fe 2+
4) Que peut-on dire des ions chlorure Cl- ? Ils sont présent au début et à la fin de la réaction, ils sont spectateurs
5) Quel est l’effet thermique associé à cette réaction chimique ? Il y a dégagement de chaleur, c’est une réaction exother-
mique.
TP Effets thermiques Corrigé
Solution ionique
Thermomètre
Réactif 1 Nitra
d’ammo-
nium
Chlorure
de so-
dium
Chlorure
de ma-
gnésium
Chlorure
de cal-
cium
Chlorure
de potas-
sium
Nitrate de
potassium
CHLO-
RURE DE
SODIUM
Chlroru
e de
sodium
Réactif 2 eau Acide
chlorhy-
drique
eau eau eau eau EAU Hy-
droxyde
de so-
dium
Temp initiale (°
C)
25.5 25.4 26.2 25.2 24.6 25.2 25.2 26.4
Temp finale(°C) 23.5 30 31.5 25.3 28.8 23.6 24.7 27.6
Type de réaction Endother-
miques
Exother-
mique
Exother-
miques
atherm-
que
exotherm-
que
endother-
miques
Endother-
mique ou
ather-
mique
exo

C. Evaporation d’un liquide et transpiration
Si après une course à pied on garde sur soi un vêtement mouillé par la sueur, une sensation de froid est ressentie
même en restant dans une pièce dont la température est sensiblement constante. Il en est de même pour un na-
geur en sortant de la piscine.
Cette sensation est encore accrue si on reste dans un courant d’air. Pourquoi ?
Ce phénomène physique est nommé effet cryogénique.
1) Quelle transformation physique est liée à l’effet cryogénique ?
Il s’agit d’une évaporation
Mise en évidence expérimentale de ce phénomène
- Agiter une sonde thermométrique dans l’air et relever la température.
- Refaire l’expérience en recouvrant le thermomètre d’un coton imbibé de liquide volatil tel que l’éthanol.
2) Que se passe-t-il ?
Lorsqu’on agite le thermomètre, avec l’alcool, la température diminue.
Expliquez le phénomène physique apparaissant dans cette dernière expérience.
L’eau (ou l’alcool) a besoin de chaleur pour s’évaporer (transformation de l’état liquide en vapeur), la température
diminue donc autour des gouttelettes d’eau ou d’alcool.
3) « L’évaporation d’un liquide s’effectue quand ce corps retire la chaleur donc l’énergie thermique à son propre
environnement ».Il doit y avoir équilibre thermique entre la peau et l’air ambiant. Donc dans l’environnement im-
mediat de la peau, la température diminue, et on a une sensation de froid.
Conclure en transposant ceci à la sensation ressentie par ces sportifs.
D. Conclusion
1) Classer les 3 expériences réalisées aujourd'hui en tant que transformations chimiques ou physiques.
Lorsqu’il y a apparition de nouveaux composés il s’agit de transformation chimique.
Lorsqu’il y a vaporisation, c’est un changement d’état donc une transformation physique.
2) Une augmentation de température traduit-elle un dégagement d’énergie ou une absorption d’énergie sous
forme de chaleur ?
Une transformaon exothermique est une transformaon
qui libère de l’énergie par transfert thermique
et la cède à ce qui se trouve dans son environnement.
Une transformaon endothermique est une transformaon
qui absorbe de l’énergie par transfert thermique.
Elle prend cee énergie à son environnement.
1
/
2
100%