cinétique chimique

Ch 9: Temps et évolution chimique: cinétique et catalyse
1. Cinétique chimique
La cinétique chimique est l’étude de l’évolution d’un système
chimique dans le temps.
On étudiera les évolutions chimiques raisonnablement
observables. Les réactions trop lentes ou trop rapides(
précipitation d’un hydroxyde doc 1 p 234 ), n’intéresseront
pas le cours.
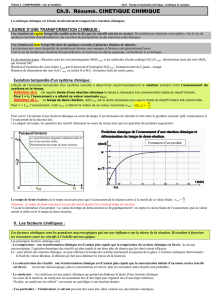
2. Les facteurs cinétiques
Faire activité expérimentale: feuille polycopiée.
Conclusions:
La cinétique augmente avec la température et avec la
concentration. Ce sont des facteurs cinétiques.

3 Les catalyseurs
3.1. Définition
Un catalyseur est une espèce qui accélère une réaction
chimique, sans être consommée par celle-ci.
Le catalyseur n’apparait donc pas dans l’équation bilan.
3.2. mode d’action d’un catalyseur
Voir l’exemple p 237 de l’oxydation des ions peroxodisulfate
par les ions iodure. Les ions fer (II) catalyse la réaction en
participants à 2 réactions plus rapides, mais avec le même
bilan chimique.
Un catalyseur permet un passage par plusieurs réactions plus
rapides que le passage direct de la réaction bilan.
3.3. Sélectivité d’un catalyseur
Doc 12 p 237.
Un catalyseur peu favoriser la formation d’un produit.

3.4 Les catalyseurs biologiques
Voir doc 13 p 238
Dans les organismes vivants les enzymes catalysent les
réactions chimiques.

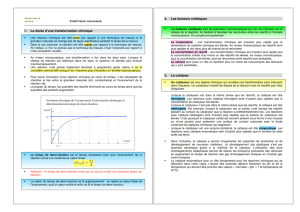
4 Suivit de l’évolution d’un système chimique
4.1. différentes techniques
Comment peut-on suivre l’évolution d’un système chimique?
Pour suivre l’évolution de système chimique, Il faut pouvoir
mesurer la concentration d’un produit ou d’un réactif et en
déduire l’avancement x de la réaction. Pour cela, on peut utiliser
un conductimètre, un pHmètre, un spectromètre si un des
participant à la réaction est coloré ou autres.
Faire suite du TP feuille polycopiée.
4.2. Temps de réaction et de demi-réaction
Le temps de réaction tfest le temps nécessaire pour que tout le
réactif limitant soit consommé. C’est à dire que l’avancement x =
xmax. Evaluer ce tfpour votre TP.
Le temps de demi-réaction t1/2 est le temps nécessaire pour que la
moitié du réactif limitant soit consommé. C’est à dire que
l’avancement x = ½ xmax. Evaluer ce tfpour votre TP.
Exercices p 241 n°1, 2, 3, 4, 10, 11, 14, 18, 22, 25,
1
/
4
100%