Lire l'article complet

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 3 - mars 2012
56
dossier thématique
Traitement du diabète
de type 2 : retour aux bases !
Prise en charge nutritionnelle
du diabète de type 2 :
certitudes et controverses
Nutritional management of type 2 diabetes: evidences and controversies
Jean-Michel Lecerf*
Points forts
Highlights
»
La diététique du diabète a toujours évolué au gré des modes
et des connaissances. De ce fait, consensus et controverses se
succèdent.
»
Souvent négligée devant l’efficacité des traitements
médicamenteux, elle joue cependant un rôle majeur dans
l’équilibre glycémique au début de l’affection et dans les
complications cardiovasculaires.
»
La perte de poids en cas d’obésité viscérale joue un rôle majeur
pour réduire la glycémie à jeun au début de la maladie, tandis
que l’index glycémique intervient davantage sur la glycémie
postprandiale.
»
La réduction du risque cardiovasculaire passe par l’amélioration
du profil lipidique grâce à une réduction modérée de l’apport
glucidique. La lutte contre le stress oxydant, des apports élevés
en acides gras ω3, des conseils sur la cuisson, un apport élevé
en fibres et modéré en sel sont les autres mesures prioritaires.
Mots-clés : Diabète – Prise en charge nutritionnelle – Glucides – Index
glycémique – Risque cardiovasculaire.
Dietary recommendations in type 2 diabetes change with
time, fashion and knowledges. So consensus and debates
alternate.
Nutritional management is often neglected due to the efficacy
of drug therapy. However it plays a major role in glycemic
control at the beginning of the disease and in cardiovascular
complications.
When there is an abdominal obesity weight loss is essential
in order to decrease glycemia, at the onset of the disease,
whereas glycemic index is mainly important for postprandial
glycemia.
Decrease of the cardiovascular risk needs the improvement
of plasma lipid profile, through a reduction of carbohydrates
intake. Fight against oxidative stress, high omega 3 fatty acids
intakes, cooking advices, high fiber and low salt intakes are
other good recommendations.
Keywords : Diabetes – Dietary management – Carbohydrates –
Glycemic index – Cardiovascular risk.
* Service de nutrition,
institut Pasteur de Lille ;
service de médecine
interne, CHRU de Lille.
L
a diététique du diabétique est souvent négligée
par les patients, peut-être en partie parce que
la nutrition en tant que discipline scientifique
n’est pas assez prise en considération par… les diabéto-
logues. En effet, la thérapeutique du diabète a fait telle-
ment de progrès depuis quelques années que patients
comme praticiens perdent parfois le sens de l’utilité
d’une prise en charge nutritionnelle adaptée. Enfin, la
nutrition est encore souvent source de controverses,
y compris en ce qui concerne le diabète, ce qui jette le
trouble et conduit à l’inaction.
Or, la nutrition joue un rôle majeur aussi bien dans la
prévention du diabète – avec la lutte contre la séden-
tarité – que dans son traitement et ses complications.
Bref historique
La diététique du diabétique a connu différentes modes
au gré de l’évolution des concepts. Alors que Claude
Bernard avait déjà montré le rôle du foie dans la pro-
duction de glucose, les médecins de la fin du XIX
e
siècle
et du début du XXe considéraient encore que, pour
réduire la glycémie, et donc la glycosurie, il suffisait de
supprimer les entrées de glucides. À une époque où
ni les sulfonylurées ni l’insuline n’existaient, on précipi-
tait ainsi l’acidocétose et la mort du patient. Jusqu’aux
années 1960-1970, la seule mesure diététique qui a
prévalu était la chasse aux glucides. Les patients en
avaient retenu “chasse au saccharose”. Ce qui est resté.

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 3 - mars 2012
57
Prise en charge nutritionnelle du diabète de type 2 : certitudes et controverses
Dans les années 1970-2000, on a pris conscience que
les patients diabétiques mouraient à la suite d’infarctus
en partie parce qu’ils mangeaient plus gras, mangeant
moins glucidique. C’est à cette époque que l’on a com-
mencé à faire la chasse aux lipides, et particulièrement
aux acides gras saturés, accusés de tous les maux : les
patients ont recommencé à manger des glucides. En
1981, D.J. Jenkins a développé le concept d’index glycé-
mique, qui avait, au moins en théorie, une application
chez le patient diabétique : il permettait de nuancer
l’élargissement de la ration glucidique grâce à la prise
en compte de l’aspect qualitatif de l’apport en glucides.
En réalité, on a assisté à une inflation démagogique
de l’apport glucidique, sous prétexte que l’index gly-
cémique du glucide considéré était bas : les patients se
sont remis à manger gâteaux, sucre et fructose !
C’est aussi l’époque où l’on disait que les patients diabé-
tiques devaient avoir une alimentation normale, comme
les gens “normaux”. Mais qu’est-ce qu’une alimentation
normale ? Des sujets “normaux” mangent-ils normale-
ment ? Les patients en ont conclu qu’ils devaient manger
comme tout le monde, ce qui est sans doute une erreur
sur le plan de l’équilibre entre les glucides et les lipides.
Sommes-nous, depuis 10 à 12 ans, entrés dans la
période de la sagesse et de l’équilibre bien compris ?
Objectifs
Les objectifs de la nutrition chez le patient diabétique
sont doubles :
✓
d’une part, contribuer à l’équilibre glycémique à jeun
et en postprandial : pour cela, la réduction du poids et
l’activité physique sont primordiales, mais pas suffi-
santes. Un choix “éclairé” du type de glucides et de la
quantité consommée semble essentiel ;
✓
d’autre part, limiter les complications qui ne relèvent
pas strictement de l’hyperglycémie : c’est le cas de l’athé-
rosclérose, mais aussi de l’hypertension artérielle (HTA),
de l’insuffisance rénale et des complications neuro-
logiques et ophtalmologiques.
Pour chacun des objectifs, nous essaierons d’analyser
si les recommandations nutritionnelles relèvent de
certitudes ou si elles font encore l’objet de discussions.
Réduire la glycémie
La glycémie à jeun
La glycémie à jeun dépend de la production hépatique de
glucose, laquelle est modulée par l’insuline (qui l’inhibe).
En cas d’insulinorésistance, la production hépatique de
glucose est principalement liée à l’obésité abdominale
via la production d’acides gras libres qui proviennent du
tissu adipeux périviscéral et qui stimulent la production
de glucose par le foie. D’autres facteurs que le surpoids
abdominal contribuent à l’insulinorésistance, notam-
ment l’inflammation bas-grade. La perte de poids est le
meilleur moyen de diminuer l’insulinorésistance chez le
patient diabétique – c'est une certitude –, à condition,
toutefois, que l’insulinopénie ne soit pas trop installée.
Il faut ajouter également que, dans toutes les études,
les patients diabétiques perdent moins de poids que
les patients non diabétiques, peut-être du fait de leur
sédentarité, de leur âge, de leur moindre masse maigre
ou de l’infiltration lipidique de celle-ci conduisant à la
lipotoxicité… Cependant, une étude récente suggère
une rémission très rapide du diabète après une res-
triction calorique drastique (régime à 600 Kcal), qui
engendre une perte de poids rapide et sévère (1).
Perdre du poids signifie réduire l’apport énergétique
et non pas l’apport lipidique seul, car cela équivaudrait
à trop accroître l’apport glucidique (en valeur relative
et/ou absolue).
L'un des paradoxes diététiques chez les patients diabé-
tiques pourrait être représenté par l’impact de la prise
du petit déjeuner sur la glycémie et sa variabilité. Une
étude préliminaire randomisée, dans le cadre d’une ali-
mentation relativement hyperglucidique (55 %), montre
une diminution de la glycémie moyenne (p < 0,06), à la
limite de la significativité, ainsi qu'une forte réduction
de la variabilité glycémique (p < 0,0001), soit – 32 %,
sur l’ensemble de la journée en l’absence de petit
déjeuner (2) !
Des pistes de recherche qui visent à modifier la flore
intestinale par des pré- ou des probiotiques, afin de
réduire l’inflammation bas-grade liée à la production
de cytokines stimulée par le lipopolysaccharide (LPS),
sont à l’étude. Nous avons pu montrer récemment que,
chez des sujets sains, la prise de prébiotiques réduisait
le LPS et les cytokines inflammatoires (3).
Le rôle des fibres (et des prébiotiques, ceux-ci étant
des fibres) ne se limite pas à cet effet. On sait qu’elles
peuvent, en modulant la fermentation colique, stimuler
la production de peptides intestinaux, notamment de
GIP, PYY et GLP-1, entérohormones produites par les
cellules endocrines de l’intestin. Or, le GLP-1 peut ralentir
la vidange gastrique, inhiber la ghréline et donc réduire
l’appétit, inhiber la production de glucagon et stimuler
celle d’insuline : cela rendrait compte, notamment, de
l’effet dit “second repas”, qui conduit à ce qu’un repas
riche en fibres diminue la glycémie à jeun avant le repas
suivant : cet effet “second repas” est bien documenté (4).
Enfin, il existe un champ d’investigations sur le rôle du
chrome dans l’insulinosécrétion, et donc dans l’équilibre
glycémique. Aujourd’hui, la synthèse des études de la

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 3 - mars 2012
58
dossier thématique
Traitement du diabète
de type 2 : retour aux bases !
littérature ne permet pas de considérer qu’il existe un
bénéfice du chrome dans la prise en charge du diabète
de type 2 (DT2) [5].
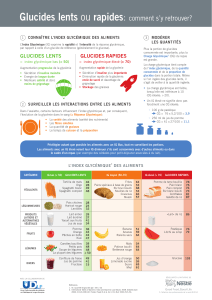
La glycémie postprandiale
Réduire la glycémie postprandiale dépend essentielle-
ment de l’index glycémique des aliments, et peut-être
plus précisément encore de la charge glycémique, c’est-
à-dire du produit de l'index glycémique par l'apport
glucidique. Un repas avec un index glycémique bas peut
entraîner une glycémie postprandiale plus basse. Or,
celle-ci est aussi un facteur de risque cardio vasculaire
(CV).
Malheureusement, l’index glycémique pose plus de
problèmes qu’il n’apporte de solutions (6). Il faut d’abord
rappeler que l’index glycémique est un paramètre méta-
bolique, et non un paramètre nutritionnel : il n’est pas
“garanti”, c’est pourquoi son étiquetage ne doit pas être
autorisé. Il résulte en effet de facteurs propres à l’aliment
(nature des glucides, composition, texture, granulomé-
trie, cuisson, teneur en protéines, en lipides, acidité,
etc.) et à l’individu (vidange gastrique, mais aussi bien
sûr utilisation du glucose et donc insulinorésistance et
insulinopénie). En conséquence, il ne peut s’appréhen-
der que pour l’ensemble de l’alimentation et donc la
somme des aliments, et, en théorie, l’index glycémique
des aliments pourrait être différent chez les sujets sains
et chez les sujets diabétiques. Une étude récente sur 5
aliments testés indique toutefois qu’il n’y aurait pas de
différence pour l’index glycémique, mais qu'en revanche,
l’index insulinémique serait différent chez les patients
diabétiques et les patients non diabétiques (7).
Alors que les études montrant l’intérêt d’une alimenta-
tion avec un index glycémique bas pour la prévention
du DT2 abondent (8), celles montrant son intérêt dans
la prise en charge du DT2 sont peu nombreuses, sur-
tout sur le long terme. Les effets des légumes secs ont
cependant été étudiés dans une méta-analyse (9), ainsi
qu’un mode alimentaire global, le régime méditerra-
néen, qui a fait l’objet de plusieurs études prouvant
qu’il pouvait entraîner une baisse de l’HbA1c (10). Très
récemment, l’étude Melbourne Collaborative Cohort
Study a montré que l’alimentation méditerranéenne
était associée à une réduction de la mortalité chez les
sujets diabétiques (11). On peut donc recommander
certains aliments tels que les légumineuses, qui ont
un index glycémique toujours bas, ainsi que les fruits,
sans excès cependant. La rétrogradation de l’amidon
telle qu’elle est obtenue avec le refroidissement (ou la
congélation du pain) diminue aussi l’index glycémique
en augmentant l’amidon résistant (12) : c’est le cas avec
les pommes de terre, le riz, les pâtes en salade.
Le vinaigre ralentit la vidange gastrique et donc l’index
glycémique, ce que plusieurs études ont bien montré.
Enfin, malgré un index insulinémique élevé, les produits
laitiers ont un index glycémique bas.
Réduire les complications
Les complications cardiovasculaires
•Équilibreglucides/lipides
On s’est longtemps exclusivement focalisé sur le cho-
lestérol LDL dans la prise en compte des lipides plasma-
tiques pour le risque CV. Or, si l’élévation du cholestérol
LDL est indéniablement un facteur du risque CV, elle
ne peut le résumer, d’autant que, chez le diabétique de
type 2, le profil lipidique est très différent de celui du
sujet à risque non diabétique, avec une élévation des
triglycérides, une baisse du cholestérol HDL du fait de
l’hypertriglycéridémie, et un cholestérol LDL souvent
normal sur le plan quantitatif, mais avec des LDL petites
et denses, athérogènes.
Or, les études sont très claires à ce sujet : la taille des
LDL est inversement corrélée aux triglycérides plasma-
tiques et à l’apport lipidique (13, 14) ; ce qui signifie que
plus l’apport lipidique est bas (et l’apport glucidique
élevé), plus les LDL sont de petite taille. À l’inverse,
lorsque l’apport lipidique est plus élevé, y compris
l’apport en acides gras saturés, les LDL sont de grande
taille (15).
Il a même été montré, dans une population de femmes
coronariennes, que la progression de l’athérosclérose
était plus grande chez celles ayant des apports lipi-
diques plus faibles et des apports glucidiques plus
élevés (16). On sait que les LDL petites et denses sont
plus oxydables, ce qui rendrait compte de leur athéro-
génicité et du fait de leur passage accru par transcytose
dans l’espace sous-endothélial.
En cas de syndrome métabolique, de DT2 ou d’obésité
abdominale, l’afflux d’acides gras provenant du tissu adi-
peux viscéral stimule la production de triglycérides au
niveau hépatique ; ceux-ci s’incorporent dans les VLDL,
devenant des VLDL très riches en triglycérides : du fait
de l’insulinorésistance et donc du déficit d’activité de la
lipoprotéine-lipase, la cascade lipolytique conduisant
des VLDL aux LDL induit, dans ce cas, des LDL petites et
denses (17). S’il existe simultanément un apport élevé
en glucides (et un faible apport en lipides), les glucides
stimulent la synthèse hépatique d’acides gras saturés
jusqu’au C16 :0. Ces acides gras saturés seront incorporés
dans les VLDL et les LDL, devenant riches en acides gras
saturés endogènes et athérogènes (18)… Globalement,
un apport glucidique compris entre 40 et 45 % de la
ration est souhaitable, avec un apport lipidique compris
entre 35 et 40 % de l’apport énergétique non alcoolique.

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 3 - mars 2012
59
Prise en charge nutritionnelle du diabète de type 2 : certitudes et controverses
Parmi les glucides les plus hypertriglycéridémiants,
il faut citer le fructose, qui, en cas d’apport élevé et
isolé (en dehors du contexte complexe des fruits), est
hypertriglycéridémiant (19), hyperuricémiant et hyper-
glycémiant, et accroît le stress oxydatif.
Le cholestérol alimentaire est peu hypercholestérolé-
miant, sauf dans des conditions particulières, car il existe
un équilibre entre l’absorption et la synthèse du cho-
lestérol d’une part, et entre les apports et l’absorption
d’autre part (quand les apports sont élevés, l’absorption
baisse) [20]. L’organisme régule parfaitement le pool de
cholestérol grâce à de nombreux systèmes sous contrôle
génétique. Il n’existe pas de lien formel entre le cho-
lestérol alimentaire et le risque CV, sauf chez les sujets
diabétiques, ainsi que l’ont montré plusieurs études
épidémiologiques (21). Il faut donc limiter son apport.
•Accroîtrelesfacteursprotecteurs
Compte tenu du risque cardiovasculaire élevé des
patients diabétiques, il est indispensable de mettre en
place des mesures de prévention précoces et efficaces,
d’où l’utilisation de statines chez la plupart des diabé-
tiques. Mais ce n’est pas suffisant. La nutrition est très
importante, et tout ce qui peut y contribuer est utile.
✓
L’accroissement des systèmes de défense antioxy-
dante : le zinc, le sélénium, les vitamines E et C, les
caroténoïdes et les polyphénols sont les principaux
nutriments considérés comme ayant des effets antioxy-
dants. Les études montrant leur bénéfice isolément au
cours du DT2 ne sont pas assez convaincantes, mais
en accroître les sources par une alimentation riche
en fruits et légumes (vitamine C, caroténoïdes, poly-
phénols), en huile végétale (vitamine E) et en produits
laitiers (zinc, sélénium) est de bon sens (22). Les ali-
ments naturellement les plus riches en polyphénols
sont les fruits, les légumes (oignons, etc.), le vin rouge,
le thé, les épices, le cacao, l'huile d’olive vierge, les
noix, le soja, etc.
L’apport en fer, et donc en viande rouge, ne doit pas
être excessif dans la mesure où il existe souvent une
hépatopathie métabolique de surcharge avec hyper-
ferritinémie, et où l’excès de fer peut induire un stress
oxydatif et peut-être exercer un effet diabétogène et
athérogène (23, 24).
✓
L’augmentation des apports en acides gras ω3 est
une mesure importante. L’apport en acide alphalinolé-
nique n’est pas suffisant en cas de diabète déséquilibré
pour obtenir une production suffisante d’acides gras ω3
à longue chaîne, car la delta 6 désaturase est insulino-
dépendante. Il faut accroître l’apport en EPA et en DHA,
qui ne peuvent provenir efficacement, pour l’instant,
que du poisson (gras), conseillé 2 fois par semaine. Les
ω3 (acide α-linolénique et ω3 à longue chaîne) ont
des effets protecteurs sur le plan des événements CV
et des troubles du rythme chez le patient diabétique,
ainsi que le suggère fortement l’étude Alpha Omega
Trial publiée en 2010 (25).
Toutefois si les ω3 à longue chaîne (EPA + DHA) peuvent,
à forte dose, réduire les triglycérides et augmenter le
cholestérol HDL (tout en élevant le cholestérol LDL, en
induisant des LDL de plus grande taille moins athéro-
gènes), ils peuvent altérer très modestement l’équilibre
glycémique en augmentant de façon non significative
l’HbA1c (26).
✓
La cuisson est un aspect trop rarement évoqué. Or,
elle induit la production de composés de Maillard qui
vont s’ajouter aux Advanced Glycated End products (AGE)
endogènes résultant de l’hyperglycémie chronique. Ces
composés néoformés, en particulier la carboxyméthyl-
lysine (CML) issue du chauffage excessif de nombreux
aliments céréaliers, exercent des effets pro-oxydants
et pro-inflammatoires, modifient le profil métabolique
dans un sens diabétogène et athérogène, et altèrent
le profil plasmatique des acides gras, ainsi que nous
avons pu le montrer chez des sujets sains (27). Chez
les patients diabétiques, leur taux élevé serait associé
aux complications vasculaires (28).
✓
Risque rénal : l’apport en protéines ne doit être ni
trop faible, pour éviter l’aggravation d’une sarcopénie
très fréquente chez le patient diabétique âgé, ni trop
élevé, car cela conduirait à un état d’hyperfiltration glo-
mérulaire. Or, les enquêtes alimentaires montrent que
les patients diabétiques ont une alimentation hyperpro-
tidique. Cependant, une méta-analyse a montré qu’un
faible apport en protéines, s’il réduisait la protéinurie,
ne semblait pas améliorer la fonction rénale de patients
diabétiques (29). Mais ces conclusions sont discutées
(30). La nature des protéines pourrait jouer un rôle
important ; une étude chez des patients diabétiques
ayant une néphropathie et utilisant des protéines de
soja a montré des résultats intéressants sur le profil
lipidique et la fonction rénale (31). Globalement, on
peut recommander sans inconvénient un apport pro-
tidique à 0,8 g/kg/j.
✓
Hypertension artérielle : la majorité des sujets dia-
bétiques est hypertendue. La réduction du poids est
la mesure essentielle permettant de réduire la quan-
tité d’angiotensinogène produit par le tissu adipeux.
Les apports en chlorure de sodium et la consom-
mation d'alcool doivent également être réduits. À
l’inverse, des apports suffisamment importants en
magnésium sont souhaitables du fait de son effet
favorable sur la pression artérielle et de son rôle dans
la glycorégulation, et du fait de l’hypermagnésurie

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - n° 3 - mars 2012
60
dossier thématique
Traitement du diabète
de type 2 : retour aux bases !
observée dans quelques études en cas de déséqui-
libre du diabète. Enfin, des apports suffisamment
élevés en calcium et en produits laitiers sont requis
en raison de la relation inverse entre ces apports et
plusieurs composantes du syndrome métabolique,
et notamment de l’HTA (32).
✓
Complications ophtalmologiques et neurologiques :
le facteur principal dans la survenue des lésions de
microangiopathie est représenté par l’importance et
la durée de l’hyperglycémie. Cependant, le rôle des
apports en acides gras essentiels est souligné par plu-
sieurs études concernant la neuropathie diabétique,
notamment à propos de l’intérêt de l’acide γ-linolénique
(C18 : 3n-6) et des acides gras ω3 à longue chaîne
(C20 : 5n-3 et C22 : 6n-3) [33]. Toutefois, des apports
élevés de ces acides gras ne peuvent pas être obte-
nus par l'alimentation, mais par des suppléments. De
même, la vitamine B1 à forte dose ou un de ses dérivés,
la benfotiamine, exercent des effets favorables sur la
rétinopathie diabétique, mais il s’agit là aussi d’effets
médicamenteux (34).
Conclusion
La nutrition du patient diabétique a des particularités
liées à la physiopathologie de la maladie et aux objectifs
recherchés. Il n’est pas exact de dire qu’elle devrait être
celle d’un sujet normal, parce que l’on ne sait pas ce qu’est
un sujet normal, ni ce qu’est une alimentation normale.
Un sujet non diabétique, actif, de poids normal, peut
consommer beaucoup de glucides, car ses triglycérides
sont normaux, son tissu adipeux adapté sur le plan quan-
titatif et fonctionnel, son oxydation lipidique normale,
son stress oxydatif modéré. Un sujet diabétique doit
souvent réduire un peu ses apports caloriques, et doit
limiter son apport glucidique à 40-45 %, en choisissant
des aliments d’index glycémique bas ; son apport lipi-
dique peut répondre aux apports nutritionnels conseil-
lés en lipides tels que définis en 2010, à savoir 35-40 %,
avec un apport élevé en acides gras ω3 (provenant du
poisson). Les apports en nutriments antioxydants, en
magnésium et en fibres doivent être élevés. Il faut limi-
ter l’apport en fructose s’il est isolé. L’apport protidique
doit être limité à 0,8 g/kg/j s’il existe une atteinte rénale ;
dans le cas contraire, il peut représenter 1 g/kg/j, soit
15 à 20 % de l’apport énergétique total. Les protéines
végétales doivent avoir une place privilégiée, notam-
ment les légumes secs et le soja. La cuisson ne doit pas
être trop appuyée, et il faut limiter les aliments grillés
(pain et pomme de terre). Les produits laitiers ont une
place significative. Le vin, en quantité modérée, peut
être maintenu, car il exerce des effets antioxydants et a
un effet favorable sur l’insulinosensibilité (35).
Il est évident qu’un sujet normal peut, sans inconvé-
nient, adopter l’alimentation d’un patient diabétique.
C’est dans ce sens que nos conseils peuvent s’exercer
plutôt que dans le sens inverse.
L’alimentation du patient diabétique peut alors ressem-
bler au régime méditerranéen (encadré), à la nuance
près que ce dernier est traditionnellement plus riche en
glucides et moins riche en protéines, car il a davantage
recours aux aliments sources de protéines végétales et
de glucides complexes.
■
D’un point de vue pratique : conseils de fréquence
•Viande : 4 fois/semaine, dont 1 ou 2 fois de la viande rouge
•Charcuterie : 1 ou 2 fois/semaine
•Œufs : 2 ou 3 fois/semaine
•Poisson : 2 ou 3 fois/semaine, dont 1 ou 2 fois du poisson gras
•Produits laitiers : 3 portions/jour, dont 1 de fromage (30 à 40 g)
• Pain complet, pommes de terre, pâtes, riz, céréales :
à chaque repas en petite quantité – selon le poids
•Légumes secs : 2 fois/semaine
•Légumes crus et/ou cuits : 2 à 3 portions/jour
•Fruits : 2 fois/jour
•Huile de colza ou de noix riche en acide α-linolénique pour l’assaisonnement
•Huile d’olive pour la cuisson
•Un peu de beurre et/ou de margarine riche en ω3 pour tartiner
•Noix, amandes en petite quantité
•Vin en petite quantité
Encadré.
 6
6
1
/
6
100%