2009-2010 Sadiki

Collège Sadiki
Devoir de contrôle n° : 2
Sciences physiques
4ème maths et Sc.Exp
Samedi 30 -01-2010
Profs : Obey-Fkih et
Cherchari
Exercice 1 : (4,5 pts) Dans une enceinte, initialement vide, de volume constant V = 2 L, on introduit 0,5 mole
d’ammoniac NH3 gazeux et 1,5 mole de dioxygène gazeux à la température T1, on obtient un système en équilibre
chimique schématisé par l’équation :
4 NH3 (g) + 5O2(g) 4 NO(g) + 6H2O (g).
1- A l’équilibre, il se forme 0,6 mole de vapeur d’eau.
a- Déterminer, en nombre de mole, la composition du mélange à l’équilibre.
b- Calcule la valeur de la constante d’équilibre K1.
1.c- Calculer le taux d’avancement final f1 de la réaction.
2- Le système chimique étant en équilibre à la température T1, on le porte à la température T2( T2>T1). Un nouvel
état d’équilibre s’établit dans lequel le nombre de mole d’ammoniac présent est ègal à 0,2mole.
a- Déterminer la nouvelle composition du mélange à l’équilibre .
b- Que peut-on conclure quant au caractère énergétique de la réaction étudiée. Justifier la réponse.
c- Comparer sans calcul T1 et T2.
3- La température étant maintenue constante et égale à T2, quel est l’effet d’une diminution de la pression
a- sur la valeur de la constante d’équilibre ?
b- sur l’équilibre du système chimique ?
Exercice 1 : (2,5 pts)
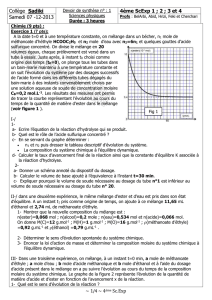
On prépare dans un erlenmeyer un mélange équimolaire d’éthanoate de butyle CH3COO-(CH2)3-CH3 , ester au
parfum de banane, et de l’eau pure, auquel on ajoute quelques gouttes d’acide sulfurique concentré. Le mélange
contient initialement a mole d’ester et a mole de d’eau. On introduit l’erlenmeyer dans un bain marie à la
température 80°C et on déclenche simultanément un chronomètre. En utilisant une technique appropriée, on a pu
tracer la courbe C1 de variation de la quantité de matière restante de l’ester (voir figure 1).
1- Écrire l’équation de la réaction d’hydrolyse.
2- Déterminer, en mole, la composition initiale et finale du système chimique.
3- À une date t=80 min, on modifie la concentration de l’un des constituants du système chimique et on suit à
partir de cette date, l’évolution de la quantité de matière restante de l’ester, ce qui nous a permis de tracer la
courbe C2 de variation de la quantité de matière restante de l’ester.
a- En utilisant le graphe et la loi de modération, déterminer le constituant dont on a modifié sa concentration et
si cette modification est une augmentation ou une diminution.
b- Calculer la quantité de matière ajoutée ou retranchée du constituant.
0,01
0,02
0,067
nester(mol) nester(mol)
t(min)
C1
C2
10
80
160
Chimie ( 7 points )

Exercice 1 ( 5 pts) :
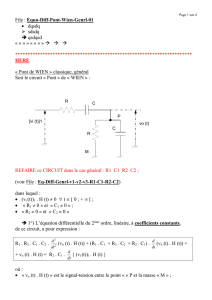
Un circuit électrique LC est constitué par :
- Un condensateur, de capacité C.
- Une bobine d’inductance L et de résistance négligeable.
- Un interrupteur K.
1- On charge le condensateur ( K ouvert) telle que l’armature A porte la
charge Q0=10-6 C. A la date t=0s, on ferme l’interrupteur K
a- Etablir l’équation différentielle régissant les variations de l’intensité i du courant dans le circuit.
b- Montrer que i(t)=Imsin(0t + i) est solution de l’équation différentielle à condition que
2
01
LC
.
Déduire l’expression de la période T0 des oscillations.
c- Déduire l’expression de la tension uC aux bornes du condensateur en fonction de Im, C,0 et i.
d- Montrer que Im=0Q0.
2- A l’aide d’un dispositif informatisé branché aux bornes du circuit on a pu tracer La courbe
représentant les variations, au cours du temps, de l’énergie magnétique EL.( la figure 2).
a- Montrer que l’énergie magnétique EL est périodique de période
0
T
T2
.
b- En utilisant le graphe, déterminer 0, L et C.
Exercice 2 ( 8 pts ) :
Un circuit série est formé par :
- Une bobine d’inductance et de résistance r inconnue.
- Un conducteur ohmique de résistance R.
- Un condensateur de capacité inconnue C=16 µF.
- Un générateur de basses fréquences délivrant une tension alternative sinusoïdale u(t)=Umsin(2Nt
+u) de fréquence N réglable et de valeur maximale Um=constante.
L’intensité instantanée du courant électrique qui circule dans le circuit est i(t)=Imsin(2Nt +i).
L'équation reliant i(t), sa dérivée première
dt )t(di
et sa primitive
idt
est :
(R+ r)i(t) +L
dt )t(di
+
C
1
idt
= u(t)
1- Représenter le schéma du circuit électrique et indiquer par un tracé clair les connexions à un
oscilloscope permettant de visualiser simultanément la tension u(t) sur la voie Y1 et la tension uC(t)
sur la voie Y2.
2- Pour une valeur N1 de la fréquence N, on observe sur l’écran de l’oscilloscope les oscillogrammes de
la figure 3
a- Déterminer la fréquence N1, l’amplitude Ucm de la tension uc(t) et calculer la valeur de l’amplitude
Im de l’intensité du courant dans le circuit.
b- Calculer le déphasage angulaire de la tension u(t) par rapport à la tension uc(t), =u - uc.
c- Montrer que =u - i=-
5
rad. Le circuit est il capacitif ou inductif ?
3- Pour la fréquence N1 et sur la la figure 4 de la page 4 ( à compléter et à rendre avec la copie) On
EL(10-6 J)
t(s)
2.10-3 s
1
2
3
4
5
Fig 2
Physique ( 13 points )
C
L
K
i
A
B
q
Fig1

donne le schéma des vecteurs de Fresnel ;OA et OB représentés à l’échelle et correspondant
respectivement aux termes u(t) et uR(t) tension aux bornes du résistor.
a- En se servant de la figure 4 déterminer la valeur de R.
b- Compléter la figure 4 en représentant les vecteurs associés aux termes de l’équation différentielle.
En déduire la valeur de r et celle de L.
4- On fait varier la fréquence N, pour une valeur N2 de N on constate que u(t) est en quadrature avance
de phase sur uc(t).
a- Montrer que le circuit électrique est dans un état de résonance d’intensité.
b- Calculer l’intensité efficace I0 du courant.
c- Montrer que l’énergie électromagnétique E de l’oscillateur étudié est constante au cours du temps.
Calculer sa valeur.
d- Calculer la puissance électrique moyenne consommée par le circuit.

Page à compléter et à remettre avec la copie
Nom et prénom : ………………………………..Classe : …………………
+
O
B
A
/5
1
/
4
100%