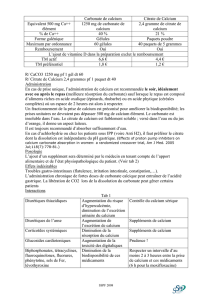
Production de gaz

11.2. Production de gaz
11.2.1. Production de dioxyde de carbone (CO2)
Réactifs
Matériel
- 100 ml de vinaigre d’alcool
- 1 c à c de carbonate de calcium
(disponible en pharmacie, sous le nom
de bicarbonate de soude)
- 1 ballon de baudruche
- 1 petit entonnoir
- 1 bouteille transparente en pvc de
0,5 l
- 1 cuillère à café
Mode opératoire
• Dans la bouteille, introduire 100 ml de vinaigre.
• A l'aide de l'entonnoir, introduire 1 cuillère à café de carbonate de calcium dans le
ballon.
• Enfiler le ballon sur le goulot de la bouteille.
• Redresser le ballon afin de faire tomber le carbonate de calcium dans la bouteille.
Explications scientifiques
Réaction chimique analogue à celle-ci :
L’explication ci-dessous, s’adresse aux 2ème et 3ème degrés.
A l’état gazeux, les molécules ne sont pas serrées du tout, elles se repoussent après s'être
cognées et s'écartent : elles occupent tout le volume offert (le gaz se disperse de lui-
même).
L’acide acétique réagit avec le carbonate de calcium (basique) pour former de l'eau et
un sel. Cela neutralise l'acide. Cette réaction produit aussi du dioxyde de carbone qui
gonfle le ballon.
Acide acétique
(vinaigre)
Carbonate de
calcium
Acétate de calcium (sel soluble)
Dégagement de dioxyde de carbone

11.2.2. Production de dioxyde de carbone (CO2): gaz extincteur
Réactifs
Matériel
- 100 ml de vinaigre d’alcool
- 1 c à c de carbonate de calcium
(disponible en pharmacie, sous le nom
de bicarbonate de soude)
- 1 bougie chauffe-plat
- 1 boite d'allumettes
- 1 bécher de 250 ml
- 1 cuillère à café
Mode opératoire
• Verser le vinaigre dans le bécher et y déposer délicatement la bougie.
• Allumer la bougie.
• A l'aide d'une cuillère à café, verser du carbonate de calcium dans le vinaigre.
Explications scientifiques
Réaction chimique analogue à celle-ci :
Le CO2 a pour effet d'étouffer les flammes, en privant le feu d’oxygène.
Acide acétique
(vinaigre)
Carbonate de
calcium
Acétate de calcium (sel soluble)
Dégagement de dioxyde de carbone

11.2.3. Production de dioxyde de carbone (CO2): l'éruption volcanique
Réactifs
Matériel
- 500 g de farine
- 250 g de sel
- 50 g de carbonate de calcium (disponible
en pharmacie, sous le nom de bicarbonate
de soude)
- 100 ml de vinaigre d’alcool
- 200 ml d'eau déminéralisée
- 30 ml d'huile végétale
- 30 ml de liquide vaisselle transparent
- Colorant alimentaire rouge et vert
- 1 grand bol
- 1 récipient gradué
- 1 cuillère à soupe
- 1 bécher de 250 ml
- 1 grand plat
- 1 bouteille en plastique vide 0.5 l
- 1 entonnoir
Mode opératoire
1. Fabrication du volcan
• Dans un bol, introduire la farine, le sel et deux cuillères à soupe d'huile. Mélanger
• Verser 150 ml d'eau dans un verre. Ajouter cinq gouttes de colorant rouge et cinq autres
de vert. Verser le tout dans le bol.
• Mélanger le tout jusqu'à l'obtention d'une pâte collante, si la pâte reste trop liquide,
ajouter de la farine.
• Poser la bouteille dans le grand plat. Avec la pâte, modeler un volcan autour de la
bouteille.
2. L'éruption
• Dans le bécher, introduire 50 ml d'eau tiède et le carbonate de calcium.
• Ajouter trois gouttes de colorant rouge et le produit vaisselle.
• A l'aide de l'entonnoir, verser le mélange dans la bouteille.
• Rincer l'entonnoir puis ajouter doucement le vinaigre.
Explications scientifiques
Réaction chimique analogue à celle-ci :
Acide acétique
(vinaigre)
Carbonate de
calcium
Acétate de calcium (sel soluble)
Dégagement de dioxyde de carbone

L’acide acétique réagit avec le carbonate de calcium (basique) pour former de l'eau et un sel. Cette réaction
produit aussi du dioxyde de carbone. La solution devient pétillante et fait mousser le produit vaisselle, ce qui pr
1
/
4
100%