D1-UE9-Cogne-Tumeurs_hypophysaires-21.02.17-pdf

1
UE9 – Hormonologie, Reproduction
Dr Muriel COGNE
Date : 21/02/2017 Ronéistes : TSANG Ronan
Plage horaire : 8h30-10h30 LEBEAU Greg
Tumeurs hypophysaires
I. Rappels sur l’hypophyse
II. Généralités sur les adénomes hypophysaires
a. Introduction
b. Sémiologie
III. Les adénomes à prolactine et l’hyperprolactinémie
a. La prolactine
b. Clinique chez l’adulte
c. Clinique chez la femme ménopausée
d. Clinique chez l’homme
e. Clinique chez l’enfant et l’adolescent
f. Examens paracliniques : la biologie
g. L’imagerie hypophysaire
h. Traitements
IV. Les adénomes thyréotropes
a. Généralités
b. Les signes de l’hyperthyroïdie
c. Le diagnostic
V. Les adénomes corticotropes ou maladie de Cushing
a. Généralités
b. Signes cliniques
c. Diagnositc
d. Traitements
VI. Acromégalie
a. Généralités
b. Clinique
c. Complications de l’acromégalie
d. Diagnostics
e. Traitements

2
I. Rappels sur l’hypophyse
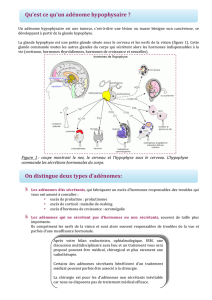
L’homéostasie hormonale est dépendante de la régulation des sécrétions hormonales périphériques ;
par la commande centrale hypothalamo-hypophysaire.
La glande hypophysaire, reliée à l’hypothalamus par la tige pituitaire, présente une structure bi-
lobaire.
L’hypophyse ou glande pituitaire est composée de deux parties : l’antéhypophyse et la posthypophyse (ou
neurohypophyse)
La posthypophyse, ne contient pas de lignées cellulaires sécrétrices, mais est constituée des
terminaisons synaptiques de neurones magnocellulaires hypothalamiques produisant la vasopressine
(ADH) et l’ocytocine. Il n’y a pas d’adénome à ce niveau.
L’antéhypophyse est composée de 5 lignées cellulaires, définies selon les hormones qu’elles
sécrètent : somatotrope (GH), thyréotrope (TSH), lactotrope (PRL), gonadotrope (LH et FSH) et
corticotrope (ACTH). Donc chacune de ces lignées cellulaires va pouvoir être à l’origine d’un
adénome.
Toutes les informations sont transmises par le biais d’un système artério-veineux très développé dans la tige,
et sont soumises à un rétrocontrôle pour tous les axes de sorte que l’on garde un équilibre tout au long du
nycthémère.

3
II. Généralités sur les adénomes hypophysaires
a. Introduction
Chaque lignée de l’antéhypophyse pourra être à l’origine d’un adénome, c’est une division cellulaire qui va
se faire, mais on ne sait pas trop pourquoi. Petit à petit va apparaître une formation qui tant qu’elle fait
moins de 10 mm, on parle de micro-adénome, et dès lors qu’elle passe la taille de 10 mm, on l’appelle un
macro-adénome. Sachant qu’un macro-adénome peut être intra-hypophysaire tant qu’il n’a pas atteint une
certaine taille puis dépasser l’hypophyse en allant vers le chiasma optique (et avoir des conséquences
autres).
b. Sémiologie
Les signes cliniques qui vont découler de cette multiplication cellulaire et donc de l’apparition d’un
adénome peuvent être dus :
Soit à une production en excès des hormones (par absence de rétrocontrôle inhibiteur), les cellules
se sont autonomisées et peuvent produire une à plusieurs hormones. Ainsi certains adénomes sont à
la fois à ACTH et à prolactine, etc.
Par le retentissement de l’adénome aux structures adjacentes (ex : chiasma, avec une atteinte du
champ visuel), c’est le syndrome tumoral.
Par l’insuffisance de sécrétion hormonale, dans le cas d’adénomes non-sécrétant, due à la présence
d’un macro-adénome qui va écraser les cellules normales de l’hypophyse.
NB : L’insuffisance de sécrétion peut aussi être due à une radiothérapie de l’hypophyse ou une chirurgie.
Enfin, on a les incidentalomes. De nos jours, on fait beaucoup d’imagerie, ce qui peut conduire à la
découverte fortuite d’adénome hypophysaire. Au scanner, on découvrira surtout des macro-adénomes, car le
scanner n’est pas le standard d’imagerie en ce qui concerne l’hypophyse. L’IRM lui est préférée, étant
beaucoup plus précise. On parle aussi d’incidentalomes surrénaliens, thyroïdiens, etc. On se retrouve à
analyser ces incidentalomes, alors qu’ils font partie du vieillissement normal des glandes, donc les explore
une fois, et après on ne s’en occupe plus.
Donc, normalement, si on explore un adénome c’est uniquement parce qu’on a des signes qui nous incitent à
aller explorer l’hypophyse.

4
Rappel de la position de l’hypophyse sur une IRM :
Les adénomes en grossissant vont faire basculer la tige pituitaire (qui est bien droite) d’un côté ou de l’autre.
Si c’est l’aileron hypophysaire gauche qui est le siège de l’adénome, la tige va basculer à droite et
inversement. Jusqu’à venir au contact du chiasma.
Profil d’un macro-adénome au contact du chiasma
On a donc dit qu’un adénome peut être hypersécrétant, et avoir les signes de la lignée qu’il hypersécrète,
ou bien silencieux (également appelé non-fonctionnel). Et peut être responsable d’un déficit hormonal
simultanément. Ainsi un macro-adénome somatotrope peut à la fois entraîner un excès de GH et une
insuffisance d’ACTH par exemple, si cette lignée cellulaire est écrasée par le volume de l’adénome. C’est
pour cette raison que lorsqu’on a une anomalie de l’hypophyse, on explore tous les axes.

5
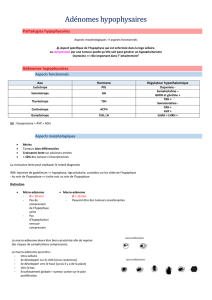
Comme on l’a dit, les adénomes peuvent toucher les 5 lignées cellulaires :
La prolactine élevée donne une hyperprolactinémie,
La TSH provoque une hyperthyroïdie,
La GH est responsable des effets sur la croissance,
L’ACTH conduit à l’hypercortisolisme,
LH et FSH sont le plus souvent responsables d’adénomes non-fonctionnels.
III. Les adénomes à prolactine et l’hyperprolactinémie
a. La prolactine
Nous allons parler des adénomes à prolactine (ou prolactinome) qui après les adénomes non-fonctionnels
sont les plus fréquents des adénomes.
Les cellules lactotropes représentent 15 à 20% de l’ensemble des cellules antéhypophysaire
fonctionnelles. C’est pour cette raison qu’après le non-fonctionnel, il sera le plus fréquent.
Elles sécrètent la PRL, polypeptide de 199 AA qui circule dans le sang sous forme de monomère ou
de polymère (big et big-big PRL), agrégats de PRL dont l’activité biologique est réduite. La
normale de la PRL est de 29 ng, parfois on peut avoir des taux très élevés, allant jusqu’à 100 000
ng alors qu’on observe pas de signes cliniques, on peut alors se demander si la prolactinémie ne
prend pas en compte les agrégats ce qui fausse les résultats. En effet, jusqu’à présent les dosages
de la prolactine n’étaient pas toujours ultra-sensibles.
La demi-vie de la PRL est de 26 à 47 mn, son élimination est principalement rénale.
Elle se fixe sur des récepteurs appartenant à la famille des récepteurs à cytokines.
La sécrétion de PRL est sous le contrôle inhibiteur de la dopamine hypothalamique, qui se fixe sur les
récepteurs D2 des cellules lactotropes. Ce seront donc ces récepteurs qui seront ciblés par la thérapeutique.
Cependant, l’hyperprolactinémie ne signifie pas toujours un prolactinome, il faut d’abord éliminer certaines
causes qui peuvent être responsables de l’augmentation de la PRL. Parmi ces causes il y a :
La pilule chez la femme, les œstrogènes conduisent à une élévation de la PRL. Il ne faut donc pas
doser la PRL sous pilule mais un mois après son arrêt.
Les antidépresseurs et tout un contexte qui vont augmenter la PRL.
Les antiémétiques, Primperan, Zofren.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%