851, 852 et 853 Lundi 3 avril 2017 DEVOIR SURVEILLE

1
851, 852 et 853 Lundi 3 avril 2017
DEVOIR SURVEILLE
n°6
GEOLOGIE ET BIOLOGIE
Sujet de type « Epreuve sur documents » du concours commun Agro – Véto
Durée 3 h
Il sera tenu compte de la qualité de la présentation et de la rédaction (orthographe, grammaire, précision de
l’expression).
L’usage d’abaques, de tables, de tout instrument électronique susceptible de permettre au candidat d’accéder à des
données et de les traiter par les moyens autres que ceux fournis dans le sujet est interdit.
Le sujet contient :
- un premier volet de géologie avec deux parties indépendantes
- un second volet de biologie avec trois parties indépendantes.
• Les réponses aux questions devront être portées directement dans les cadres prévus à cet effet (en se limitant
strictement à ces cadres).
• Répondre aux questions posées et à elles seules, selon les modalités indiquées dans le sujet.
• Les documents pourront être annotés directement sur la copie (sans les découper ni les coller).
• Les pages du sujet ne seront pas dissociées.
Le sujet comporte 16 pages

2
GEOLOGIE
PARTIE I – Durée conseillée 1 h
Source des documents :
JF MOYEN sur le site de l’ENS Lyon http://planet-terre.ens-lyon.fr/planetterre/XML/db/planetterre/metadata/LOM-adakites.xml
Les adakites sont des roches volcaniques particulières qui se forment en contexte de subduction, dans des secteurs
relativement localisés. Leur nom provient de l’île d’Adak, dans les Aléoutiennes, où elles ont été décrites initialement.
Elles se distinguent des B.A.D.R. (Basalte, Andésite, Dacite, Rhyolite) de la série calco-alcaline classiquement
rencontrées par l’absence de termes basiques (basaltiques).
Document 1. Diagrammes
alcalins – silice et K – Na – Ca.
N.B. : les points noirs sont les
adakites étudiées. Al = alcalin :
Th = tholéiitique.
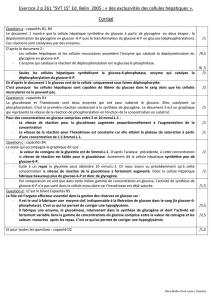
Question 1. Comparer les caractéristiques des adakites et des roches B.A.D.R. en utilisant les informations
du document 1.

3
Document 2. Comparaison de la composition chimique des
adakites (moyenne de 81 analyses) et des dacites (moyenne
de 80 analyses) pour les éléments majeurs et pour les
éléments traces (terres rares) marqueurs de la source
magmatique.
Remarque : une ppm correspond à un rapport de 10-6 soit, par
exemple, 1 mg par kg.
Question 2. Quelles informations supplémentaires le document 2 apporte-t-il ?

4
Document 3. Les adakites de Patagonie (Amérique du Sud).
Document 3a (à gauche). Schéma structural de la région étudiée. L’âge de la croûte est indiqué en millions
d’années (Tmy).
Document 3b (au milieu). Age de la plaque plongeante en fonction de la latitude.
Document 3c (à droite). Teneur en Yb des laves formées le long de la fosse (Ytterbium : élément trace, terre
rare). Les cercles noirs correspondent aux adakites, les cercles blancs aux BADR.
Question 3. A partir de l’exploitation des documents 3a et 3b, indiquez quel contexte géodynamique
particulier permet d’expliquer la production d’adakites.
Question 4. En relation avec les documents précédemment étudiés, analysez et interprétez les teneurs en
terres rares des laves étudiées sur le document 3c.

5
Afin de déterminer quel est le matériau source qui subit la fusion partielle, on soumet en laboratoire différentes roches
à une fusion partielle et on analyse le spectre de terres rares des liquides magmatiques obtenus.
Document 5. Spectres de terres rares comparant les adakites (ronds noirs) avec les liquides modélisés,
formés dans différents cas :
- fusion d’une péridotite à grenat,
- fusion d’une amphibolite (basalte métamorphisé contenant de la hornblende, qui est une amphibole),
- fusion d’une amphibolite à grenat (basalte métamorphisé dans des conditions où le grenat peut apparaître).
Les surfaces grises donnent la composition des liquides formés en fonction du taux de fusion partielle F.
Les courbes avec les ronds blancs indiquent le spectre obtenu avec le liquide issu de la fusion d’un manteau
chondritique (non différencié) à gauche, avec celui issu de la fusion d’un basalte tholéiitique non métamorphisé au
milieu et à droite.
Question 5. A partir de l’analyse des données fournies, quel matériau source pouvez-vous proposer pour le
magma à l’origine des adakites ? Que pouvez-vous proposer pour le taux de fusion partielle ?
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%