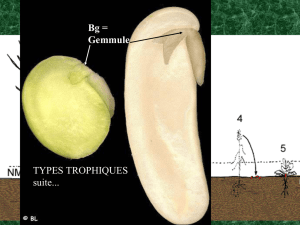
feuilles

Morphogénèse du bourgeon végétatif,
conséquences pour l’étude de la dormance et du
débourrement (determinisme endogène et
exogène de l’endo et de l’éco dormance)
GDR-2968 : Antibes 18-19/04/2013
Marc Bonhomme

Cette morphogénèse est la résultante du fonctionnement d’un méristème
que l’on appelle primaire
(les méristèmes dit
secondaires que sont le
cambium et le
phellogène permettent la
croissance en diamètre
des axes)
Les méristèmes
primaires se
situent en bout de
l’axe (apex) ou
des racines et en
position axillaire à
la base des
feuilles
Un méristème est constitué au départ d’une ou plusieurs cellules
méristématiques
Schema : www.unisciel.fr

Une cellule méristématiques est une cellule indifférenciée « totipotente »
doté d’une forte capacité de multiplication (c’est l’équivalent d’une cellule
souche)
Elle présente généralement des plastes rudimentaires, de petites vacuoles,
de nombreuses mitochondries et un rapport nucléocytoplasmique proche
de 1
Schéma:
Benjaminray.eu/energiesdusoleil

Ces cellules vont se multiplier en se divisant dans différents plans
On parle de divisions anticlines et
périclines selon que la division se
fait perpendiculairement à la
surface (pour les couches L1 et
L2) ou parallèlement à la surface
(les divisions sont anticlines et
periclines pour L3)
En s’éloignant progressivement les cellules vont se différencier ce qui
conduit à la structure d’apex
1 - zone centrale
2 - zone périphérique
3 - méristème médullaire
4 - tissus médullaires (issus du méristème médullaire)
(Source : Dakdada - Wikipedia)
Schémas: www.afd-ld.org/~fdp_bio

Contrôle interne du fonctionnement du méristème
État méristématique est associé l’expression de quelques gènes importants
Clavata (massue)
1 et 2 : codent pour un récepteur
3 : code pour une petite protéine qui vient se liguer au récepteur
Ceci entraine la répression de WUS , favorise la différenciation
Sa mutation provoque un dôme méristématique très grand (en massue)
Wuschel (WUS ébouriffé) : qui permet de maintenir l’état méristématique
(donc si l’expression de WUS est réprimée, la différenciation est accélérée et
des ébauches apparaissent dans la zone centrale). Il s’exprime à la base de
la ZC et code pour un facteur de transcription
STM (shoot meristemless): qui permet de maintenir l’état méristématique
indifférencié. Il code pour une protéine qui inhibe la différenciation. Sa
mutation entraine l’absence de méristème (arabidopsis)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
1
/
42
100%