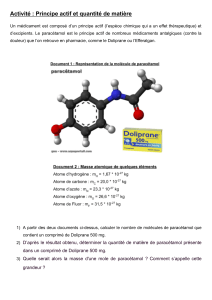
15 chap 2 synthese quantite de matiere

LA PRATIQUE DU SPORT
Chap. 2 Quantité de matière
2nde – Synthèse Chap. 2 Page 1 sur 2 C. Grange-Reynas
I – Qu’est-ce qu’une quantité de matière ?
Une nouvelle unité de quantité de matière : la mole
On appelle mole la quantité de matière qui contient autant d’entités qu’il y a d’atomes dans 12,00 g de carbone 12
Ce nombre d’entités est appelé nombre d'Avogadro et sera noté NA.
NA = 6,02.1023 mol-1
Une mole contient 6,02.1023 entités élémentaires.
II – Comment définir et calculer une masse molaire ?
La masse molaire atomique est la masse d'une mole d'atomes de cet élément. Elle se note M et s’exprime souvent
en g.mol–1 (même si son unité S.I. est le kg.mol-1)
Les masses molaires atomiques figurent dans le tableau périodique des éléments.
Un atome 𝑋
𝑍
𝐴 possède A nucléons. Une mole de cet atome correspond donc à A moles de nucléons.
Comme la masse d’une mole de nucléon vaut 1 g, la masse d’une mole d’atome 𝑋
𝑍
𝐴 vaut A grammes.
A l’état naturel, un mélange d’atomes est toujours un mélange d’isotopes et la masse molaire moyenne doit tenir
compte des proportions des différents isotopes. C’est pourquoi les masses molaires atomiques apparaissent avec un
nombre décimal.
Exemple : Masse molaire atomique du chlore (75,8 % de chlore 35 et 24,2 % de chlore 37)
75,8 x 35/100 + 24,2 x 37/100 = 35,5 g.mol-1
La masse molaire moléculaire est la masse d'une mole de molécules de l'espèce considérée.
On la calcule en effectuant la somme des masses molaires atomiques des atomes qui constituent la molécule.
Exemple : Masse molaire de l'eau H2O : M(H2O) = 2 x M(H) + M(O) = 2 x 1 + 16 = 18 g.mol-1
III – Comment déterminer une quantité de matière ?
Relation entre masse et quantité de matière
Soit M la masse d'une mole d'entités chimiques.
La masse de n moles de ces entités est m = n x M d'où :
IV - Concentration molaire
Concentration molaire
C =
𝑛
V
C : Concentration molaire (en mol.L-1).
n : Quantité de matière du soluté (en mol).
V: Volume de la solution (en L).
Relation entre concentration massique et concentration molaire : C =
Cm
M
n: quantité de matière (en mol).
m: masse de l'échantillon (en g).
M: masse molaire (en g.mol-1).

LA PRATIQUE DU SPORT
Chap. 2 Quantité de matière
2nde – Synthèse Chap. 2 Page 2 sur 2 C. Grange-Reynas
Quantité de matière et dilution
Facteur de dilution : F = VFille
VMère F = CMère
CFille
La quantité de matière se conserve lors d’une dilution n = CMère x VMère = CFille x VFille
1
/
2
100%