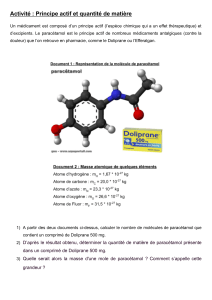
LES MOLES

A nombre d’AVOGADRO N
Lorsqu’on s’intéresse au nombre d’atomes de fer contenu dans un clou en fer, ou encore au nombre de molécules d’eau contenu dans
un verre d’eau, ces nombres deviennent vite très grands et difficiles à déterminer compte tenu de la petite taille des entités (atomes,
molécules ..) considérées.
En chimie, lorsqu’il s’agit de compter un nombre d’entités chimiques, on doit définir un nombre N d’entité chimique de référence
qui soit judicieux.
EXEMPLE.
1- Calculer le nombre d’atomes de fer dans un clou en fer pur de 25g
2- Calculer le nombre de molécules d’eau dans un verre d’eau de 200 mL
Données : structure des noyaux : (voir classification périodique) m(proton)=m(neutron) = 1.67 x 10-27 kg , la
masse des électrons est négligeable.
L’unité de quantité de matière s’appelle la mole ( c’est en quelque sorte une « boite » d’atome contenant
un grand nombre d’atomes ).Dans cette mole il y a N = 6.02x1023 atomes. Ce nombre s’appelle le
nombre d’AVOGADRO donc
N = 6.02x1023 mol-1 (nbre d’atomes par mole)
raison de ce choix :
1- Calcul 1 : Un atome d’hydrogène a une masse mh = 1.67x10-27 kg , quelle est la masse M d’une
mole d’atome d’hydrogène ( en g avec 1 chiffre significatif)
2- Calcul 2 : même question (avec 2 chiffres significatifs) pour le carbone dont la masse est mc =
2x10-26 g
3- Conclusion : Faire un lien entre les 2 résultats précédents et les symboles des noyaux de ces deux
atomes (voir classification)
B – Masse molaire
1- Masse molaire atomique
a. Relever les masses molaires des éléments suivants : O, N, Na. Comparer avec les nombres de
masse.
b. Le chlore est un élément chimique possédant 2 isotopes
Cl
35
17
(75% des atomes) et
Cl
37
17
(25% des
atomes ) Quelle serait la masse molaire du chlore s’il n’était constitué que de chlore 35 ? que de
chlore 37 ? Quelle est la masse molaire du chlore dans ces proportions isotopiques naturelles ?
justifier.
2- masse molaire moléculaire
a. Une molécule d’eau H2O contient combien d’atomes d’H et O ? une mole d’eau contient
combien de mole d’H et de mole d’O ?
b. Quelle est la masse molaire MH2O d’une mole d’eau ?
c. Calculer les masses molaires des composés chimiques suivants : ammoniac : NH3 ;
saccharose : C12H22O11 ; caféine : C8H10N4O2
3- Masse molaire ionique :
a. Pourquoi peut-on dire que la masse molaire d’un ion est égale à la masse molaire de l’atome
correspondant ?
C AU BISTROT
Combien de morceau de
sucre le garçon va-t-il
apporter au client ?
Données : voici un paquet
de 1 kg de sucre n°4
LES
MOLES
1
/
1
100%