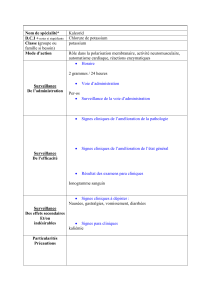
1L/1ES : Qualité des sols et de l`eau Thème : Nourrir l`humanité

1L/1ES : Qualité des sols et de l’eau Thème : Nourrir l’humanité
Activité expérimentale : La chlorose une maladie courante dans les jardins
Objectif :
Proposer et mettre en œuvre un protocole expérimental de dosage par comparaison.
La chlorose est une maladie assez courante dans les jardins. Elle se traduit par
une décoloration prononcée des feuilles. Cette décoloration est due à un manque de
la photosynthèse provoquée par une carence dans le sol.
La carence la plus courante concerne le fer (on parle alors de chlorose ferrique)
mais il peut aussi s'agir d'une carence du sol en magnésium, en potassium,
en azote, en zinc, en phosphore. En effet, tous ces éléments sont indispensables
à la plante dans son travail de photosynthèse responsable de la fabrication
de la chlorophylle qui donne la couleur verte aux feuilles.
Pour traiter cette déficience, on peut utiliser un produit phytosanitaire dont
l’étiquette indique généralement qu’il contient du sulfate de fer (II).
Situation – Problème
Les deux photos ci-dessous (Voir vidéoprojection) représentent la même plante (Haie de fusain) provenant de deux jardins
différents utilisant deux produits phytosanitaires différents A et B, à base de sulfate de fer.
En vous appuyant sur les deux indices qui suivent, apporter une explication quant à la différence entre les deux
produits phytosanitaires.
Proposer un protocole expérimental permettant de vérifier votre explication. La soumettre au professeur.
1L/1ES : Qualité des sols et de l’eau 1/2
Plante atteinte de chlorose
(Voir vidéoprojection)
Haie de fusain atteinte d’un début de chlorose
et traitée avec le produit B.
Haie de fusain saine et traitée avec le produit A.

Questions préliminaires :
Que contient principalement une solution aqueuse de phytosanitaire à base de sulfate de fer (II) ?
Donner la signification d’un produit phytosanitaire.
Indice.1 :
Comment réagissent en solution les ions fer II avec les ions permanganate d’une solution aqueuse de permanganate de potassium ?
Lorsqu’on ajoute un faible volume d’une solution violette de permanganate de potassium à une solution contenant des ions
fer II, la couleur violette disparaît brusquement.
On continuant à verser progressivement la solution de permanganate de potassium, il arrive un moment où la couleur violette
persiste et ne disparaît plus : à ce moment le volume versé V1 de la solution de permanganate de potassium est
proportionnel à la concentration C0 en ion fer (II) de la solution de sulfate de fer.
Indice.2 :
Vous disposer de :
Une solution de permanganate de potassium acidifiée de concentration C1 = 0,01 mol.L-1
Un volume V0 = 10 mL d’une solution S0 de sulfate de fer (II) de concentration C0 connue : C0 = 0,10 mol.L-1
Deux solutions SA et SB de volume VA = VB = 10 mL des deux produits phytosanitaires A et B.
Le matériel suivant :
1L/1ES : Qualité des sols et de l’eau 2/2
1
/
2
100%