Chap.1 : Phénotypes en relation avec l`activité de - SOS-SVT

Le phénotype est l’ensemble des caractères observables d’une cellule, d’un organisme.
Le génotype est l’ensemble des gènes d’une cellule, d’un organisme.
Protéine : macromolécule constituée d’une séquence d’acides aminés.
I. Des phénotypes à différentes échelles.
O
OC
C
:
:
L
Le
e
p
ph
hé
én
no
ot
ty
yp
pe
e
p
pe
eu
ut
t
s
se
e
d
dé
éf
fi
in
ni
ir
r
à
à
d
di
if
ff
fé
ér
re
en
nt
te
es
s
é
éc
ch
he
el
ll
le
es
s
:
:
d
de
e
l
l’
’o
or
rg
ga
an
ni
is
sm
me
e
à
à
l
la
a
m
mo
ol
lé
éc
cu
ul
le
e.
.
L
Le
es
s
p
ph
hé
én
no
ot
ty
yp
pe
es
s
a
al
lt
te
er
rn
na
at
ti
if
fs
s
s
so
on
nt
t
d
du
us
s
à
à
d
de
es
s
d
di
if
ff
fé
ér
re
en
nc
ce
es
s
d
da
an
ns
s
l
le
es
s
p
pr
ro
ot
té
éi
in
ne
es
s
c
co
on
nc
ce
er
rn
né
ée
es
s.
.
O
OM
M
:
:
s
s’
’i
in
nf
fo
or
rm
me
er
r
à
à
p
pa
ar
rt
ti
ir
r
d
de
e
d
do
oc
cs
s
,
,
s
sy
yn
nt
th
hé
ét
ti
is
se
er
r
s
so
ou
us
s
f
fo
or
rm
me
e
d
de
e
t
ta
ab
bl
le
ea
au
u.
.
Etude des documents sur la drépanocytose.
TD 1 : Tableau des phénotypes de la maladie.
A. Le phénotype macroscopique.
Un individu atteint de drépanocytose se différencie par un ensemble de caractères constituant
le phénotype macroscopique, c’est-à-dire à l’échelle de l’organisme : comme l’anémie, des
troubles vasculaires, des crises articulaires.
Phénotype alternatif : variation d’un même caractère, présentées par différents individus au
sein d’une population.
B. Le phénotype cellulaire.
Les hématies, ou globules rouges, sont des cellules qui transportent dans le sang le dioxygène
jusqu’aux cellules.
Le phénotype cellulaire (GR falciforme) explique le phénotype macroscopique.
C. Le phénotype moléculaire.
Le dioxygène est transporté par les hématies fixé à une molécule : l’Hémoglobine.
1. La structure primaire des protéines.
Les acides aminés forment une classe variée de molécules et présente une propriété qui
permet de les définir : ils ont tous un groupement carboxyle (acide) et un groupement
amine lié au même carbone (alpha). Leur variété provient de la chaîne latérale, elle aussi
attachée au carbone alpha. Les cellules utilisent les aa pour construire des protéines qui sont
des polymères d’aa. Il existe une vingtaine d’aa utilisés par les êtres vivants.
La liaison covalente entre deux aa est appelée liaison peptidique. La chaîne d’aa est
également appelée polypeptide.
Chap.1 :
Phénotypes en relation avec l’activité de protéines spécifiques.

La structure primaire, ou séquence, d'une protéine correspond à la succession linéaire des
acides aminés la constituant. Chaque type de protéine a une séquence particulière d’aa.
L’Hb drépanocytaire S diffère de l’HbA au niveau d’un seul aa en position 6 de la chaîne
bêta.
2. La structure secondaire.
Certains fragments d’une chaîne polypeptidique se replient sous forme de feuillet bêta ou
d’hélice alpha. Ce sont les éléments de la structure secondaire des protéines. Ces modes de
repliement sont dus à la formation de liaison hydrogène entre les groupement N-H et C-O du
squelette polypeptidique.
3. La structure tertiaire.
Elle correspond aux repliements de la chaîne protéique. Ces repliements étant liés à
l'existence de résidus encombrants ou chargés. La structure de la molécule s'organise alors
selon les trois directions de l'espace.
Cette structure est stabilisée par :
• Des liaisons hydrogènes entre les résidus d'acides aminés (exemple : ser ---lys).
• Des liaisons ioniques (exemple : glu ---lys).
• Des liaisons hydrophobes (ou Van der Waals) entre les résidus apolaires.
• Des ponts disulfures entre les résidus de cystéine (n'existent pas dans le cas de la
myoglobine).
De plus pour ce type de structure (structure globulaire), les résidus d'acides aminés apolaires
se situent préférentiellement au centre de la structure où ils peuvent s'associer par liaisons
hydrophobes. Tandis que les résidus polaires ou ioniques se situent à la périphérie où ils
La myoglobine

peuvent s'associer entre eux par liaison hydrogène ou ionique, ou encore avec l'eau par
liaison hydrogène.
4. La structure quaternaire.
Elle correspond à l'association de plusieurs sous unités protéiques (les monomères) pour
former une protéine. Les sous unités peuvent être liées entre elles par :
• Des liaisons hydrogènes entre les résidus d'acides aminés de deux sous unités(exemple
: ser --- lys).
• Des liaisons ioniques de deux sous unités(exemple : glu ---lys).
• Des liaisons hydrophobes (ou Van der Waals) entre les résidus apolaires de deux sous
unités.
• Des ponts disulfures entre les résidus de cystéine de deux sous unités(n'existent pas
dans le cas de l'hémoglobine).
L’Hb est une protéine formée de 4 sous-unités : 2 chaînes alpha et 2 chaînes bêta. L’Hb S n’a
pas la même structure spatiale que l’HbA, elle forme des fibres rigides peu solubles dans le
cytoplasme des hématies. Ce qui explique le phénotype cellulaire.
BILAN: LES PHENOTYPES OBSERVES AUX DIFFERENTES ECHELLES, MOLECULAIRE,
CELLULAIRE ET MACROSCOPIQUE, SONT LIES ENTRE EUX ET DECOULENT DES PROPRIETES
D’UNE CATEGORIE DE MOLECULE : LES PROTEINES.
Intro du II. Documents de transition II.
Lire seuls le document 1 en répondant aux questions suivantes :
1. Quelle molécule est directement responsable de la pigmentation de la peau ?
L’hémoglobine

2. Comment explique-t-on la différence de coloration entre une peau claire et
une peau foncée ?
puis lire ensemble le document 2 avec explications et arriver à intro du II ci-
dessous.
Les différences de couleur de peau dépendent de la quantité d’un pigment : la mélanine,
contenue dans la peau. Une succession de réactions chimiques aboutit à la production de
mélanine à partir de la tyrosine. Chaque réaction nécessite l’intervention d’une enzyme.
Les enzymes sont des protéines nécessaires aux réactions chimiques se déroulant dans les
cellules.
II. L’importance de la structure spatiale des protéines : les enzymes.
A. Les enzymes : des catalyseurs biologiques.
TP 1 Hydrolyse du saccharose.
Les protéines enzymatiques sont des catalyseurs synthétisées par des cellules
vivantes, elles sont donc appelées biocatalyseurs. Elles permettent d’augmenter la vitesse
des réactions chimiques qui seraient possibles sans elles (mais qui seraient à des vitesses trop
faibles).
Les enzymes ne font pas partie du bilan réactionnel car elle sont intactes en fin de réaction.
Elles sont alors disponibles pour catalyser une nouvelle réaction ce qui explique qu’elles
soient actives à de faibles concentrations.
B. La double spécificité des enzymes.
TP 1 GOD/spécificité de substrat.
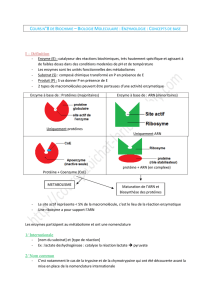
Chaque enzyme ne peut agir que sur une molécule bien précise, on dit qu’elle a une
spécificité de substrat.
Rque : Les enzymes sont généralement nommées en additionnant le suffixe -ase au nom de
leur substrat.

A l’aide des 3 documents ci-dessus montrer que les enzymes ont une spécificité
d’action.
Les enzymes ont également une spécificité d’action, c’est-à-dire qu’elle ne catalyse qu’une
réaction chimique.
Rque : La nature des réactions chimiques catalysées constitue le critère essentiel de leur
classification : ligase, hydrolase, transférase…
C. L’activité enzymatique
TP 1 : GOD, Vitesse de réaction et quantité de substrat.
Obtention de la courbe v = f([S])
La vitesse de la catalyse est fonction croissante de la concentration en substrat. Puis elle se
stabilise à un niveau constant correspondant à la Vmax. A partir de ce moment peu importe la
quantité de substrat ajouté, v = Vmax = constante.
Comment expliquer cette observation ?
Document : A partir d’un même substrat, plusieurs produits…Bordas 1èreS, 2001.
 6
6
 7
7
1
/
7
100%