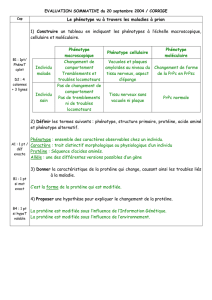
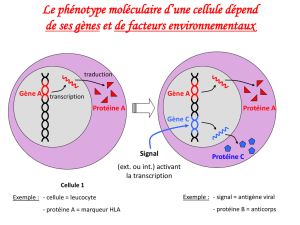
1S_P1_chp1

TOUS PAREILS
TOUS DIFFÉRENTS
Qu’elle est l’origine de nos ressemblances ?
Qu’elle est l’origine de nos différences ?

Thème : Des phénotypes à différents
niveaux d’organisation du vivant
DU GÉNOTYPE AU PHÉNOTYPE,
RELATIONS AVEC L’ENVIRONNEMENT
Chp1 : Le phénotype dépend des protéines
Problématique : Sur quoi repose le phénotype de
chaque individu ?

INTRODUCTION
-Caractères spécifiques
-Variations propres à chaque individu
-Programme génétique
- Influence des conditions de vie

Chromosomes
Gènes (unité d’info.
génétiques à l’origine
d’un caractère donné)
Génotype
Gènes
Caractères
Phénotype
-Morphologiques
-Anatomiques
-Physiologiques
-Biochimiques …

I –La réalisation des phénotypes
A –Le phénotype peut se définir à différentes échelles
Exemple 1 : L'hypercholestérolémie familiale
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
1
/
33
100%