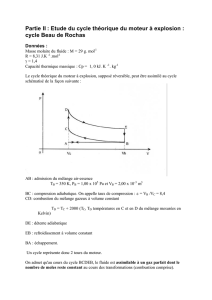
MP* – DS DE CHIMIE N°1 (durée : 2 heures) – 13 /10/ 2015

MP* – DS DE CHIMIE N°1 (durée : 2 heures) – 13 /10/ 2015
PROBLÈME N°1 : OXYDATION DU SOUFRE (adapté de Capes 2005)
Les grandeurs thermodynamiques indiquées dans les données seront supposées constantes dans le
domaine de température considéré. Tous les gaz seront assimilés à des gaz parfaits.
Constante des gaz parfaits : R = 8,31 J. mol-1.K-1.
Pression standard : P° = 1 bar = 105 Pa.
Composition centésimale molaire de l'air : N2 : 80 % ; O2 : 20 %.
Grandeurs standards de réaction à T0 = 298 K et sous P° = 1 bar.
Composés
O2(g)
N2(g)
SO2 (g)
SO3(g)
S(s)
Entropie molaire standard :
S° ( J.mol-1.K-1)
205
248
257
Enthalpie standard de formation :
ΔfH°(kJ.mol-1)
0
- 297
- 396
0
Capacité calorifique molaire à
pression constante :
Cp° ( J.mol-1.K-1)
34,2
30,6
51,1
La synthèse industrielle de l'acide sulfurique est réalisée à partir de l'oxydation du soufre par le
dioxygène de l'air selon un procédé en plusieurs étapes.
Une combustion totale du soufre est d'abord réalisée dans un four en présence d'un excès de dioxygène.
A la sortie du four de grillage, le mélange gazeux contenant l'azote de l'air, le dioxyde de soufre et
l'excès de dioxygène est ensuite transformé en trioxyde de soufre grâce à l'action d'un catalyseur solide,
le pentoxyde de vanadium V2O5.
Obtention du dioxyde de soufre SO2
La combustion totale du soufre par le dioxygène de l'air est représentée par l'équation bilan (1) :
(1) S(s) + O2(g)
→
SO2(g)
Le dioxygène apporté par l'air est introduit en excès de sorte que l'on fait brûler n0 moles de soufre
dans le four de façon à ne consommer que la moitié de la quantité initiale de dioxygène introduit.
1. Déterminer en fonction de la quantité initiale n0 en soufre, la quantité de chacun des gaz présents
avant et après la combustion.
2. Calculer l'enthalpie standard ΔrH° de la réaction de combustion, qui sera supposée indépendante
de la température.
La réaction est-elle exothermique ou endothermique ? Justifier la réponse et indiquer les
conséquences éventuelles.
3. Un mélange, constitué de soufre et d'air en excès dans les proportions indiquées ci-dessus, entre à
T0 = 298 K dans le four de combustion. On admet que, lors de la réaction, le système gazeux évolue
de manière adiabatique et sous une pression constante P = P° = 1 bar.
Présenter la méthode de détermination de la température finale T
f de combustion adiabatique et
isobare et calculer sa valeur.

Synthèse du trioxyde de soufre SO3
Les gaz restant après la combustion précédente des n0 moles de soufre sont refroidis après leur sortie
du four. Avant l'introduction dans le réacteur, la composition molaire initiale du mélange gazeux est
10 % en O2, 10 % en SO2 et 80 % en N2. La synthèse de SO3 en phase gazeuse est réalisée à une
température de 815 K en présence d'un catalyseur solide V2O5(s).
(2) SO2(g) + 1/2 O2(g) = SO3(g)
4. On définit le rendement ρ de la synthèse comme étant le rapport entre la quantité de SO2
transformée et la quantité de SO2 initiale.
4.a- Dans les conditions expérimentales exposées ci-dessus, exprimer les quantités de matière en O2,
N2, SO2 et SO3 à l'équilibre en fonction de n0 et de l’avancement ξ de la réaction (2).
4.b- Exprimer le rendement ρ de la synthèse de SO3 en fonction de ξ et de n0.
4.c- Établir l'expression du quotient réactionnel Q
r en fonction de la pression P, de la pression
standard P° et du rendement ρ.
5. On considère que l'enthalpie standard et l'entropie standard de la réaction (2) sont indépendantes
de la température pour l'intervalle de température considéré.
5.a- Exprimer la constante thermodynamique d'équilibre K° en fonction de la température T et
calculer sa valeur numérique à 815 K.
5.b- Quelle valeur prend le quotient réactionnel Qr à l'équilibre ?
6. La synthèse est effectuée à la température T = 815 K et sous une pression constante de 1 bar à
partir d'un mélange initial constitué de 0,05 mole de O2, 0,05 mole de SO2 et 0,4 mole de N2.
Par dissolution dans l'eau, on prélève à la sortie du réacteur les gaz SO2 et SO3. A l'aide d'un dosage
approprié, on détermine la quantité n1 = 0,0062 mole de SO2 prélevé.
6.a- Déterminer la composition du mélange gazeux à la sortie du réacteur puis calculer le rendement
ρ de la réaction dans ces conditions.
6.b- Calculer numériquement le quotient réactionnel Qr à la sortie du réacteur et interpréter la valeur
numérique obtenue.
7.a- Définir, puis calculer la variance v du système dans les conditions précédentes.
8. A partir des conditions expérimentales décrites ci-dessus, on cherche à déterminer l'influence de
la pression et de la température sur le rendement de la synthèse de SO3.
8.a- Quelle est l'influence d'une augmentation de la température sur la synthèse de SO3 (justifier la
réponse) ? Pourquoi refroidit-on le mélange gazeux obtenu par combustion du soufre avant de le
diriger vers le réacteur de synthèse de SO3 ?
8.b- Quelle est l'influence d'une augmentation de pression sur la synthèse de SO3. Justifier la
réponse.

PROBLÈME N°2 : PRODUCTION DE DIHYDROGÈNE (extrait de e3a-PC-2010)
Les gaz sont assimilés à des gaz parfaits ; constante des gaz parfaits : R = 8,31 J.K-1.mol-1.
Elément
ou
composé
Enthalpie standard
de formation à 298
K (ΔfH°) en
kJ.mol−1
Entropie molaire
standard à 298 K
(S°) en J.K−1.mol−1
CH4(g)
− 74,4
186,3
H2O(liq)
− 285,2
69,9
H2O(g)
− 241,8
188,8
Cgraphite
0
5,7
O2(g)
0
205,2
CO(g)
−110,5
197,7
CO2(g)
− 393,5
213,8
H2(g)
0
130,7
N2(g)
0
191,5
L’électrolyse de l’eau permet de produire du dihydrogène de grande pureté mais son coût
élevé nécessite une source d’énergie électrique bon marché. Si l’oxydation partielle des
hydrocarbures ou la transformation thermochimique de la biomasse sont en plein essor, c’est le
reformage du méthane à la vapeur d'eau (procédé appelé vaporeformage) qui est la réaction la plus
employée à l’échelle industrielle.
Les combustibles utilisés renfermant des produits sulfurés, une première opération de désulfuration
est réalisée à 400 K sur le méthane ; à la sortie de cette unité de traitement, le mélange gazeux équimolaire
en H2O et CH4 est porté à la température de 1223 K sous une pression constante de 10 bars, en présence de
catalyseurs au nickel ; l’équation bilan de la réaction de reformage s’écrit :
[1]
1. Déterminer la variance du système constitué des quatre gaz, dans les proportions de la réaction et
commenter le résultat.
2-a. Calculer à 298 K, l'enthalpie standard de réaction ΔrH1°(298 K), ainsi que l'entropie standard de
réaction ΔrS1°(298 K).
2-b. Quelle est l'influence d'une élévation de température, à pression constante, sur le déplacement
de l'équilibre [1] ? Justifier la réponse.
Comment peut-on agir sur la pression pour favoriser la conversion du méthane ?
Compte tenu des valeurs des capacités thermiques molaires à pression constante des constituants
du mélange gazeux, il est possible de calculer les expressions, en fonction de la température T, de
l’enthalpie standard et de l’entropie standard de réaction :
ΔrH1°(T) = 191,8 + 46,6.10-3.T (kJ.mol-1) ; ΔrS1°(T) = - 50,8 + 46,6.lnT (J.K-1.mol-1)
La pression standard à toute température T est P° = 1 bar.
2-c. Déterminer la valeur de la constante d’équilibre à 1223 K.
2-d. Partant du mélange d’une mole de méthane et d’une mole d’eau, obtenu à la fin de l'opération
de désulfuration, exprimer les pressions partielles à l’équilibre des différents gaz à la sortie du
reformeur en fonction de x, avancement de la réaction [1] et de la pression P.
On travaille à P = 10 bar.
Calculer x ainsi que les valeurs des différentes pressions partielles dans les conditions de l’opération
de reformage.

L’état d’équilibre obtenu précédemment se trouve modifié par l’ajout, à température et
pression constantes, d’une petite quantité d’eau .
2-e. Déterminer le sens de déplacement de l’équilibre.
En réalité, l'équilibre de reformage du méthane s'accompagne toujours de l'équilibre suivant
: [2]
pour lequel l'enthalpie libre standard de réaction vaut : .
Considérons le mélange équimolaire de méthane et d'eau placé dans les mêmes conditions de
température et de pression que précédemment (question 2-d) et appelons "y" le degré d'avancement
de la réaction [2].
3-a. Déterminer les valeurs de x et de y, en supposant que y << x. Que dire de cette approximation ?
3-b. La pression totale demeurant égale à 10 bar, calculer la pression partielle en CO2 à la sortie du
reformeur.
Le mélange gazeux obtenu à la sortie du reformeur ne contient pas exclusivement du
dihydrogène ; pour le purifier, il convient d’éliminer le dioxyde de carbone de ce mélange.
4. Proposer une technique possible pour réaliser cette purification.
Au sein de la cellule élémentaire de la pile à combustible qui sera alimentée en dihydrogène, du
carbone est susceptible de se déposer simultanément à la conversion du méthane, selon deux
réactions :
• Équilibre de Boudouard : [3]
pour lequel : ;
• Réaction directe de craquage du méthane : [4]
pour laquelle : .
Question ouverte
5- Étudier, dans chacun des cas, la possibilité pour le carbone de se déposer.
1
/
4
100%