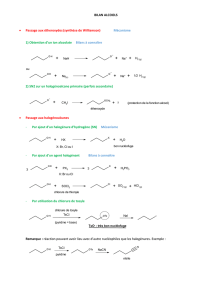
Feuille d`exercices

Exercices sur le réactif limitant
1. L’équation chimique équilibrée suivante décrit la réaction entre l’aluminium et
le chlorure de cuivre (II). Sachant que 0,25g d’aluminium réagissent avec
0,51g de chlorure de cuivre (II), détermine le réactif limitant.
2 Al(s) + 3CuCl2(aq) 2Cu(s) + 2 AlCl3 (aq)
2. Le fluorure d’hydrogène, HF(g) , est un gaz très toxique. Il se forme au cours
d’une réaction de déplacement double entre du fluorure de calcium CaF2 et de
l’acide sulfurique concentré H2SO4.
CaF2(s) + H2SO4(aq) 2HF(g) + CaSO4(s)
Détermine le réactif limitant lorsque 10,0g de CaF2 réagissent avec 15,5g de
H2SO4.
3. Lorsqu’une réaction se produit entre 3,76g de zinc et 8,93 x1023 molécules de
chlorure d’hydrogène, lequel de ces réactifs est en excès?
4. Dans l’industrie du textile, le chlore sert à décolorer les tissus. On se
débarrasse de tout le chlore toxique qui reste après le procédé de décoloration
en le faisant réagir avec une solution de thiosulfate de sodium , Na2S2O3(aq).
Na2S2O3(aq) + 4 Cl2(g) + 5H2O(l) 2NaHSO4(aq) + 8HCl(aq)
Lorsque 135kg de Na2S2O3 réagissent avec 50,0kg de Cl2 et 238kg d’eau,
quelle masse de NaHSO4 (en grammes) prévoit-on obtenir?
5. On peut préparer du fluorure de manganèse (III) en faisant réagir de l’iodure
de manganèse (II) avec du fluor.
2MnI2(s) + 13F2(g) 2MnF3 (s) + 4 IF5(l)
a) Si 1,23g de MnI2 réagissent avec 25,0g de F2, quelle masse de MnF3
devrait-on obtenir?
b) Combien de molécules de IF5 ont été produites en a)?
c) Quel est le réactif en excès? Combien en reste-t-il à la fin de la
réaction?
Réponses :
1) CuCl2 2) CaF2 3)HCl 4) 4,23 x 104g 5)a)0,446g b)4,80 x1021 c)F2 , 24g
1
/
1
100%