Données physico-chimiques et toxicologiques :

- 1 -
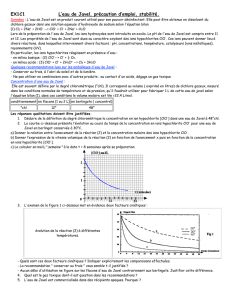
OXYDATION D’UN ALCOOL SECONDAIRE
I. Manipulation
1. Oxydation d’un alcool secondaire
On envisage l’oxydation du diphénylméthanol par une solution d’eau de Javel. L’équation associée à la
réaction qui a lieu est : OH O
+ ClO- = + Cl- + H2O
diphénylméthanol diphénylméthanone
Le diphénylméthanol est mis en solution dans l’acétate (éthanoate) d’éthyle.
L’eau et l’éthanoate d’éthyle ne sont pas solubles. Les deux réactifs se trouvent donc dans deux
phases différentes : la réaction entre les ions hypochlorite et le diphénylméthanol ne peut avoir lieu qu’à
l’interface des deux solvants. Pour améliorer le rendement de la réaction, on met en œuvre une
catalyse par transfert de phase en ajoutant au milieu réactionnel de l’hydrogénosulfate de
tétrabutylammonium.
NHSO4
Les quatre groupements butyle de l’ion tétrabutylammonium lui permettent d’être soluble dans la phase
organique. En migrant vers la phase organique l’ion tétrabutylammonium y transférera l’ion hypochlorite
ClO- qui se trouvera alors dans la même phase que le diphénylméthanol.
La catalyse par transfert de phase a été découverte par le chimiste polonais Makosza en 1965. Elle
consiste à réaliser une réaction dans un milieu diphasé organique/aqueux en présence d'un catalyseur
pouvant se partager entre les deux milieux, comme un ion ammonium quaternaire R4N+.
Le schéma ci-dessous illustre le processus de catalyse par transfert de phase.
Phase organique
Phase aqueuse
N(Bu)4 + ClO + alcool cétone + Cl + N(Bu)4
N(Bu)4 + ClO + HSO4 + Cl
ClO + HSO4 + Cl + N(Bu)4
2. Expériences préliminaires
2.1. Mise en évidence de la catalyse par transfert de phase
• Dans un tube à essais, introduire environ 2 mL de dichlorométhane et quelques cristaux de
permanganate de potassium.
• Ajouter 2 mL d’eau distillée. Boucher le tube et agiter. Noter les observations.
• Ajouter une pointe de spatule de catalyseur par transfert de phase.
• Boucher le tube et agiter. Noter les observations.

- 2 -
2.2. Dosage de l’eau de Javel
La prise d’essai d’eau de la solution d’eau de Javel est mise en présence d’une solution d’iodure de
potassium (KI). Le pH de la solution est alors ajusté par ajout d’une solution d’acide éthanoïque de
concentration voisine de 2 mol.L-1.
L’équation associée à la réaction d’oxydoréduction qui a lieu dans le milieu réactionel est :
ClO-(aq) + 2 H+(aq) + 2 I-(aq) = I2(aq) + H2O
Le diiode est ensuite dosé par une solution de thiosulfate de sodium jusqu’à disparition de la couleur
brune. I2 aq + 2 S2O32- aq = 2I- aq + S4O62- aq
Dosage de la solution S d’eau de Javel utilisée lors ce cette séance de TP. La solution S est une
solution commerciale à 9,6% de chlore actif diluée 2 fois.
- Diluer 10 fois la solution S. Soit S’ la solution diluée.
- Dans un erlenmeyer contenant 20 mL d’une solution d’iodure de potassium de concentration
massique voisine de 100 g.L-1, introduire E=10,0 mL de solution diluée S’ d’eau de Javel puis
introduire sous agitation 10 mL d’une solution d’acide acétique de concentration voisine de 2
mol.L-1.
- Doser à l’aide d’une solution de thiosulfate de sodium de concentration molaire CT = 0,100 mol.L-1
jusqu’à décoloration de la solution (ajouter quelques gouttes d’empois d’amidon en fin de dosage
pour déterminer le volume V1 à l’équivalence avec précision).
3. Synthèse de la diphénylméthanone
3.1. Comparaison des rendements de la synthèse en présence et en absence de catalyseur
On réalise deux milieux réactionnels identiques, l’un contenant en plus le catalyseur.
• Dans deux erlenmeyers A et B introduire :
- 100 mL de la solution S d’eau de Javel
- 3,68 g de diphénylméthanol
- 50 mL d’acétate d’éthyle
• Placer les deux erlenmeyers sous agitation magnétique.
• Introduire 0,68 g d’hydrogénosulfate de tétrabutylammonium dans l’erlenmeyer B.
• Laisser réagir pendant 45 min
Détermination des concentrations résiduelles en au de Javel dans les solutions SA et SB
• Au bout de 45 min, prélever 10,0 mL de phase aqueuse SA et SB contenue respectivement
dans les erlenmeyers A et B.
• Diluer 10 fois ces prélèvements. Soient S’A et S’B les solutions obtenues.
• Doser l’eau de Javel restant en suivant le même mode opératoire qu’au § 2.2. : Dans un
erlenmeyer contenant 20 mL d’une solution d’iodure de potassium de concentration
massique voisine de 100 g.L-1, introduire 10,0 mL de solution diluée S’A (S’B) puis introduire
sous agitation 10 mL d’une solution d’acide acétique de concentration voisine de 2 mol.L-1.
Doser à l’aide d’une solution de thiosulfate de sodium de concentration molaire 0,100 mol.L-1
jusqu’à décoloration de la solution (ajouter quelques gouttes d’empois d’amidon en fin de
dosage pour déterminer le volume à l’équivalence avec précision). On notera V2 le volume à
l’équivalence pour la solution S’A et V3 le volume à l’équivalence pour la solution S’B.
En déduire les valeurs des avancements de la réaction d’oxydation avec et sans catalyseur.
3.2. Isolement et purification de la diphénylbutanone
- La phase organique contenue dans l’erlenmeyer B est séparée par décantation (ampoule à
décanter).
- Laver deux fois la phase organique avec 40 mL d’une solution saturée de chlorure de sodium
- Laver deux fois la phase organique avec 40 mL d’eau
- Sécher la phase organique avec du sulfate de magnésium
- Eliminer le solvant par distillation simple. En fin de distillation, on travaillera sous pression
réduite pour éliminer « complètement » le solvant. Si un évaporateur rotatif est disponible, on
pourra l’utiliser pour effectuer cette opération. Le contenu du ballon à distiller se présente sous
forme d’une « huile ».

- 3 -
- Transférer le contenu du ballon à distiller dans un bécher. On observe alors l’apparition d’un
solide après refroidissement.
- Sécher puis peser le solide brut obtenu. La masse de produit brut est notée m1.
- Recristalliser le solide obtenu dans le minimum d’heptane. On note m2 la masse de produit brut
engagé dans la recristallisation et m3 la masse de produit pur obtenu.
4. Analyses
! Mesurer la température de fusion du produit recristallisé.
! Réaliser une C.C.M sur gel de silice :
! Effectuer trois dépôts :
- phénylméthanol en solution dans le dichlorométhane (fourni par le centre) ;
- phénylméthanone de référence en solution dans le dichlorométhane (fourni par le
centre) ;
- produit recristallisé dans le dichlorométhane (si la recristallisation n’a pas été faite et si
tout le solvant n’a pas été éliminé, on pourra utiliser une solution de l’huile obtenue dans
le dichlorométhane).
! Eluer avec du dichlorométhane
! Révéler sous UV (254 nm).
! Déterminer les valeurs des Rf
II. Questions
1) Ecrire les demi-équations d’oxydoréduction des couples :
- HClO/Cl-
- diphénylméthanone/diphénylméthanol.
En déduire l’équation de la réaction qui est associée à la transformation réalisée dans ce TP.
2) Etablir la relation
10
ECV
2
1
)S(C T1 ×
×
=
utilisée pour le calcul de la concentration de la solution S d’eau de Javel.
3) Etablir la relation
EC)VV(
2
1
xTi1
×
−
=
permettant le calcul de l’avancement final x de la réaction d’oxydation du diphénylméthanol (avec Vi
= V2 ou V3).
4) Etablir les relations littérales permettant le calcul
• Du rendement R1 de la synthèse en produit brut
• Du rendement R2 de la recristallisation
• Du rendement R3 de la synthèse en produit pur
5) Pourquoi les deux premiers lavages se font-ils avec une solution saturée de chlorure de sodium ?
6) Expliquer, en quelques lignes, le principe de la recristallisation.
7) Citer un test caractéristique des aldéhydes et des cétones
8) Citer un test caractéristique des aldéhydes.

- 4 -
III. Données et sécurité
(toutes les températures de changement d’état sont données sous une pression de 1,013 bar)
Diphénylméthanol M = 184,24 g.mol-1
Tfus = 65 - 67 °C
Teb = 297 - 298 °C
R : 36/37/38
S : 26-36
Diphénylméthanone M = 182,22 g.mol-1
Tfus = 47 - 51 °C
Teb = 305 °C
R : 36/37/38
R : 52/53
S : 26
Hydrogénosulfate de
tétrabutylammonium. M = 339,53 g.mol-1
Tfus = 169-171°C R : 36/37/38
R : 22
S : 26
Acétate d’éthyle M = 88,1g.mol-1
Teb = 77 °C
d =0,902
R11 R36
R66 R67
S16
S26
S33
dichlorométhane M = 84,9 g.mol-1
Teb = 40 °C ; d = 1,42 R : 40
S : 23-24/25-
36/37
Heptane M = 100,21 g.mol-1
Teb = 98 °C R11 R38
R50/53
R65
R67
S : 9-16-29-33-
60-61-62
Eau de Javel (mélange de
chlorure et d’hypochlorite de
sodium en milieu basique)
M(NaClO) = 74,4 g.mol-1 R 31-36/38
S 28-50

- 5 -
IV. Techniques mises en jeu
1. La décantation
L'ampoule est agitée à l'horizontale. Il faut la
dégazer après chaque agitation pour éliminer
toute sur- ou sous-pression ; le robinet de
l'ampoule est alors dirigé vers une zone
inoccupée du laboratoire. L'ampoule ne doit
jamais être remplie au delà des 2/3 pour
assurer une bonne agitation.
phase organique
phase aqueuse
à éliminer
Pour savoir où est la phase aqueuse dans l'ampoule, on
peut observer le trajet d'une goutte d'eau introduite dans
le col de l'ampoule après décantation.
2. La recristallisation.
Technique de la recristallisation.
On utilise un erlenmeyer surmonté d’un réfrigérant à eau.
Le solide brut est placé dans l’erlenmeyer, surmonté du réfrigérant. Le solide doit est juste couvert par
le solvant de recristallisation. Le mélange est porté à reflux et ajoutera du solvant, par le haut du
réfrigérant, en petites portions, en laissant le reflux s’établir entre chaque addition jusqu'à obtenir une
dissolution quasi-totale. Le chauffage est alors réglé de façon à maintenir une ébullition douce.
réserve de
solvant
La solution est, si nécessaire, filtrée rapidement à chaud sur Büchner chaud pour éliminer les
impuretés insolubles.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%