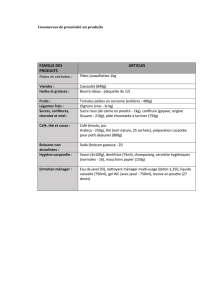
TD 1 prépas en ligne - Poly

Daniel Abécassis. Année universitaire 2009/2010
CHIMIE.
TD I : structure de la matière-Solutions électrolytiques.
Révisions sur les réactions chimiques.
Exercice 1/
Déterminer les structures de Lewis des molécules suivantes :
1/ L’eau :
OH
2
2/ L’ammoniac :
3
NH
3 / L’acide méthanoique 22
HCO
4 / Le Chloro-méthane : ClCH
3
5/ le trichlorure de phosphore :
3
PCl
données : Z(H)=1. Z(C )=6 ; Z(N)=7 ; Z(O)=8; Z(Cl)=17 Z(P)=15.
Exercice 2/
L’atome de phosphore a pour symbole
P
31
15
1/ Donner la stucture électronique de cet élément.
a/ en utilisant les couches K,L,M
b/ en utilisant la notion de sous couches s,p,d.
2/ Calculer la masse d’un atome de
P
31
15
3/ On utilise souvent la relation suivante pour calculer la masse d’un atome :
N
mAM .=où
N
mest la
masse d’un neutron. Utilisez cette relation pour calculer la masse d’un atome
P
31
15
.
4/ Qelles sont vos remarques ? Expliquez pourquoi, d’après vous, on a nomé A le nombre de masse.
Exercice 3/
QCM :
1/ un atome possède 5 électrons sur sa couche de valence. Sa valence vaut :
a/ Trois b/ quatre c/ cinq.
2/ Parmi les molécules suivantes, identifier celle qui ne peut exister :
a/
33
0CHHC −− b/ 22
CHHC
=
c/
33
CHClHC −− d/
HOCHC
−
−
≡
3/ Pour satisfaire la règle de l’octet dans une molécule, un atome tend à adopter la structure électronique
du gaz rare qui le :
a / précède. b/ le suit dans la classification périodique.

Exercice 4/
On veut préparer 2L d’une solution d’acide chlorhydrique de concentration C=0,1mol/L. On dispose
pour cela d’une solution plus concentrée qui contient , en masse, 30% de HCl et dont la masse volumique
vaut :
1
152,1
−
=kgL
ρ
. On devra donc la diluer. Quel volume de cette solution faut-il utiliser ? Combien
faudra-t-il ajouter d’eau ?
Exercice 5/
L’acétylène 22
HC
peut se préparer par action de l’eau sur le carbure de calcium 2
CaC
selon la réaction :
22222
)(2 OHCaHCOHCaC
+
→
+
Un spéléologue veut utiliser une lampe à acétylène qui consomme 10L de ce gaz (mesurés dans les
conditions normales de température et de pression) par heure de fonctionnement. Il compte rester 8
heures sous terre. Combien doit-il emporter de carbure de calcium ( en grammes ) et d’eau ( en litres) ?
On donne : Ca : 40g/mol
Exercice 6 :
On brûle complètement 8,7g d’un composé A de formule brute
OHC
yx
. On obtient 19,8g de dioxyde de
carbone et 8,1g d’eau.
1/ Ecrire l’équation de réaction de la combustion complète de A.
2/ D’après le bilan molaire et les données du texte, déterminer la relation entre x et y.
3/ Exprimer la quantité de matière du composé A. En déduire les valeurs de x et de y.
Exercice 7 :
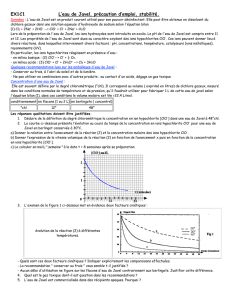
L’eau de javel est obtenue par l’action de dichlore gazeux sur une solution d’hydroxyde de sodium.Le
principe actif de l’eau de javel est l’ion hypochlorite
−
ClO
qui est responsable de l’action décolorante sur
les textiles. On caractérise la teneur en ions hypochlorite d’une eau de javel par son degré
chlorométrique : c’est le nombre de litres de dichlore gazeux mesuré dans les conditions normales de
température et de pression, qui sont absorbés lors de la préparation de 1L de solution d’eau de javel.
1/ Ecrire l’équation de la réaction de préparation de l’eau de javel. Que peut-on dire du dichlore au
cours de cette réaction ?
2/ Un flacon d’eau de javel porte l’indication
°
12
chlorométrique. Calculer la concentration en ions
hypochlorite de cette eau de javel.
Exercice 8/
On mélange 1g de poudre d’aluminium et 6g de diiode. La réaction est amorcée par quelques gouttes
d’eau ( qui est le catalyseur de cette réaction).
1/ En vous aidant des représentations de Lewis des atomes d’alumunium et d’iode, trouver la formule du
produit formé. On donne Z(AL)=13 et Z(I)=53 (famille des halogènes).
2/ Ecrire l’équation de la réaction.
3/ La réaction s’arrête par manque d’un des réactifs. Lequel ? Calculer la masse de produit formé. On
donne M(Al) :27 et M(I) :127g/mol.

1
/
3
100%