Montage 14 Le dichlore et l`eau de javel Introduction Importance du

Montage 14 Le dichlore et l'eau de javel
Introduction
Importance du dichlore en chimie organique et de l'eau de Javel dans la vie
quotidienne
I Préparation du dichlore et de l'eau de Javel
1) Le procédé Deacon
2) Préparation du dichlore par action de l'acide chlorhydrique sur le
permanganate de potassium
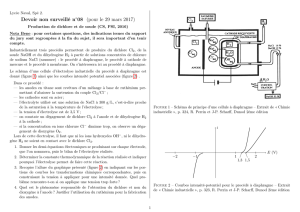
3) Electrolyse d'une solution de NaCl
a) Anode en graphite, cathode en fer
NaCl = 2 M U = 4 V
- montrer la formation de Cl
2
par décoloration d'une solution d'indigo
- montrer la formation de H
2
et le rougissement de la phénolphtaléine
2 Cl
-
= Cl
2
+ 2 e
-
H
2
O + e = 1/2 H
2
+ OH
–
b) Refaire la manipulation dans un bécher sous agitation dans la glace
Identifier l'eau de javel avec une solution d'aniline (2 gouttes dans un bécher)
II Propriétés oxydantes du dichlore et de l'eau de Javel
1) Oxydation de l'eau oxygénée : formation de l'oxygène singulet
Faire barboter du dichlore dans une éprouvette contenant 75 mL de soude à 0,5 M et
25 mL d'eau oxygénée à 110 volumes.
Equation Cl
2
+ H
2
O
2
+2 OH
-
=>
1
O
2
+ 2 Cl
-
+ 2 H
2
O
2) Oxydation des ions iodures et des ions ferreux
a) Dans un tube à essai, ajouter de l'eau de chlore à une solution très diluée de
sulfate ferreux ammoniacal (fraîchement préparée). On caractérisera la formation
d'ions ferriques par addition de soude. Mettre un tube témoin
b) Ajouter de l'eau de chlore dans 2 tubes à essais contenant une solution diluée
d'iodure de potassium et de bromure de potassium, respectivement. Dans le premier
cas, ajouter un peu de cyclohexane dans le tube à l'issue de la réaction.

III Réaction en chimie organique
1) Substitution radicalaire
Mettre 1 volume de dichlore et 1 volume de méthane dans une éprouvette à gaz et la
laisser retournée en présence de lumière sur une cuve saturée en eau salée.
2) Addition électrophile sur un alcène
Réaliser l'expérience avec l'éthylène, même mode opératoire que précédemment mais
sans lumière
IV Dosage d'une eau de Javel commercial par oxydoréduction
Cf Le Maréchal
Conclusion
Le dichlore et l'eau de Javel sont surtout recherchée pour leur caractère oxydant et
donc désinfectant
1
/
2
100%