Durée : 2h Coefficient 2

5PYMSAG1 Page 1 / 4
BACCALAUREAT TECHNOLOGIQUE
SESSION 2005
SCIENCES MEDICO-SOCIALES
--------------------
EPREUVE de SCIENCES PHYSIQUES
Durée : 2h Coefficient 2
La clarté des raisonnements et la qualité de la rédaction interviendront pour une part importante
dans l’appréciation des copies.
L’usage des instruments de calcul est autorisé.
Le sujet comporte 4 pages.
-A- CHIMIE
(12 POINTS)
I. L’ASPARTAME (6 points)
1. L’aspartame est un édulcorant dont l’hydrolyse acide suivie d’une neutralisation donne trois
corps.
L’acide aspartique (Asp)
CH2COOHCH
NH2
HOOC
La phénylalanine (Phe)
H2N COOHCH
CH2C6H5
Le méthanol CH3OH
1.1 L’acide aspartique et la phénylalanine appartiennent à une même famille chimique,
laquelle ?
1.2 Justifier la réponse précédente en entourant et en nommant dans la formule recopiée
de la phénylalanine les groupes fonctionnels caractéristiques.
1.3 Recopier la ou les formules des molécules ci-dessus possédant un atome de
carbone asymétrique. Indiquer celui-ci par un astérisque (*).
1.4 Représenter la molécule de D-phénylalanine en projection de Fischer.

5PYMSAG1 Page 2 / 4
2. On veut préparer un dipeptide en faisant réagir ensemble la molécule d’acide aspartique et
celle de phénylalanine.
2.1 Écrire l’équation d’une réaction possible.
2.2 Nommer le dipeptide obtenu en utilisant les abréviations Asp pour l’acide aspartique
et Phe pour la phénylalanine.
3. Le méthanol formé lors de l’hydrolyse acide est un corps toxique.
3.1 Calculer la masse maximale de méthanol susceptible d’être libérée par un litre de
boisson contenant 1,7.10-3 mol d’aspartame sachant qu’une mole d’aspartame donne
une mole de méthanol.
3.2 Expliquer pourquoi il faut bloquer l’hydrolyse de l’aspartame par du citrate de sodium
dans une telle boisson.
Donnée : Masse molaire du méthanol M = 32 g.mol-1
II. L’EAU DE JAVEL (6 points)
1. L’eau de Javel s’obtient par réaction du dichlore sur une solution aqueuse d’hydroxyde de
sodium.
L’équation de cette réaction s’écrit :
Cl2 + 2 ( Na+ + OH-) 2 Na+ + Cl- + ClO- + H2O
1.1 Donner le nom de chaque ion présent en solution dans l’eau de Javel.
1.2 Cette réaction de fabrication de l’eau de Javel est une réaction d’oxydoréduction.
Écrire les deux couples redox mis en jeu sachant que les ions Na+ n’interviennent
pas dans la réaction.
2. Un berlingot de 250 mL d’eau de Javel a un degré chlorométrique valant 48° chl.
2.1 Définir le degré chlorométrique d’une eau de Javel.
2.2 Quel est le volume de dichlore dans les conditions normales de température et de
pression nécessaire pour préparer ce berlingot de 250 mL ?
3. L’eau de Javel est utilisée comme désinfectant grâce à ses propriétés oxydantes.
3.1 Quel est l’ion responsable des propriétés désinfectantes de l’eau de Javel ?
3.2 Pour mettre en évidence ces propriétés oxydantes, on fait réagir de l’eau de
Javel sur une solution de sulfate de fer II.
Compléter l’équation ci-dessous correspondant à cette réaction.
Les ions sulfate et sodium qui ne réagissent pas ne figurent pas dans l’équation
6 Fe2+ + 3 ClO- + 3 H2O 2 Fe(OH)3 + 4 ……. + 3 ……….

5PYMSAG1 Page 3 / 4
-B-PHYSIQUE
(8 POINTS)
MASSE VOLUMIQUE, PRESSION ET ECOULEMENT
Les 3 parties sont indépendantes.
Un jardinier amateur a installé une cuve à proximité de sa cabane à outils. Il récupère l’eau de
pluie tombant sur la toiture et dispose ainsi d’une réserve d’eau pour arroser les plantes
cultivées.
Il a également placé 2 robinets pour utiliser cette eau : au pied de la cuve (position B) et au bout
de son jardin (position C). Les deux robinets sont dans le même plan horizontal.
Données :
Masse volumique de l’eau : = 1000 dans l’Unité du Système International
Intensité de la pesanteur : g = 9,8 N.kg-1
1ère partie :
1.1 La masse volumique est définie par la relation :
ρ = m
V
Identifier les termes m et V. Préciser leur unité dans le Système International.
1.2 La cuve possède une capacité maximale de 1200 litres. Calculer la masse stockée lorsque
la cuve est totalement remplie. (1 m3 = 1000 L)
2ème partie :
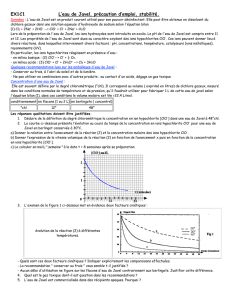
L’eau stockée dans la cuve occupe un volume correspondant à une hauteur h = 1,4 m. il s’agit
également de la dénivellation entre la surface de l’eau (point A) et le robinet (point B).
La loi fondamentale de la statique des fluides donne la différence de pression p entre 2
positions dans un liquide au repos : p = .g.h
2.1 Calculer la différence de pression p entre les points A et B.
B
cuve
C
A
h = 1,4 m

5PYMSAG1 Page 4 / 4
2.2 En quelle position la pression est-elle la plus élevée : point A ou point B ?
2.3 Sachant que la pression de l’eau au point A est égale à la pression atmosphérique de
valeur pA = 1013.102 Pa, calculer la pression pB de l’eau au robinet au point B.
3ème partie :
On s’intéresse maintenant à l’utilisation du deuxième robinet (point C) situé au bout du jardin.
3.1 Du fait de l’écoulement de l’eau dans la canalisation de B vers C, la pression de l’eau
au second robinet sera-t-elle supérieure ou inférieure à celle du premier robinet ?
3.2 Le jardinier parvient à remplir un arrosoir de volume V = 10 litres en une durée de 50
secondes. Montrer que le débit vaut : D = 0,2.10-3 m3.s-1.
3.3 La canalisation possède une section constante de surface S = 4.10-4 m². on suppose
que l’écoulement de l’eau y est laminaire.
a) Donner l’expression du débit D en fonction de la vitesse moyenne d’écoulement
vM et de la surface de la section S.
b) À partir de la valeur du débit donné à la question précédente, déterminer la
vitesse moyenne d’écoulement vM de l’eau dans la conduite.
1
/
4
100%