Version Pdf - Société Française de Rhumatologie

Société Française de Rhumatologie
Les Publications sélectionnées
Revue du Rhumatisme 73 (2006) 337-344
Infections sur prothèses articulaires : conditions du diagnostic et traitement
Jean-Marc Ziza *, Valérie Zeller, Nicole Desplaces, Patrick Mamoudy
* Auteur correspondant.
Adresse e-mail : [email protected] (J.-M. Ziza).
Unité de traitement des infections ostéoarticulaires, groupe hospitalier Diaconesses-Croix-Saint-Simon,
hôpital de la Croix-Saint-Simon, 125, rue d’Avron, 75020 Paris, France
Reçu le 14 octobre 2005 ; accepté le 4 février 2006
Disponible sur internet le 03 mars 2006
Mots clés : Nodulite rhumatoïde ; Polyarthrite rhumatoïde ; Nodule sous-cutané ; Vascularite
Keywords: Rheumatoid nodulosis; Rheumatoid arthritis; Rheumatoid nodules; Vasculitis
1. Introduction
Le succès d’une prothèse articulaire, après échec d’un traitement médical rhumatologique, semble maintenant évident à tous qu’il
s’agisse d’une prothèse de hanche ou de genou, les plus communément mises en place. Ainsi, environ 100 000 prothèses par an sont
implantées en France dans une hanche et 50 000 dans un genou. Ces chiffres vont vraisemblablement augmenter en raison du
vieillissement de la population et d’une certaine banalisation de cette intervention dans une population plus jeune. Pourtant, malgré
l’amélioration des procédures d’antibioprophylaxie et de lutte contre les infections nosocomiales, le risque pour un patient de voir
s’infecter sa prothèse reste encore trop important : moins de 1 % pour la hanche ou l’épaule et moins de 2 % pour le genou, articulation
plus superficielle [1]. Il est probable que ces chiffres soient sous-évalués. L’infection d’une prothèse constitue pour un patient souvent
âgé un drame à l’origine d’une morbidité difficilement acceptable pour un acte à visée fonctionnelle et parfois d’un risque de mortalité en
cas d’atteinte aiguë (septicémie). Pour la société, le coût du traitement est majeur car, se conjuguent interventions et hospitalisations
souvent itératives, antibiothérapies de longue durée, arrêts de travail et séquelles sévères pour les plus jeunes. Une telle infection risque
de survenir tout au long de la vie du malade. Le diagnostic est trop souvent méconnu, source de retards thérapeutiques préjudiciables.
Le traitement reste mal codifié car les patients sont très hétérogènes et nous ne disposons pas d’études prospectives et randomisées. Les
critères de diagnostic d’une infection sur prothèse et les formes cliniques observées sont eux-mêmes discutés et varient selon les
équipes. Un certain nombre de principes semble cependant se dégager, au premier rang desquels la nécessité d’un diagnostic précoce et
d’une prise en charge spécialisée, gage du succès thérapeutique, parallèlement aux mesures préventives.
2. Physiopathologie
Sa connaissance est indispensable pour comprendre les conditions du diagnostic et du traitement. Quel que soit le mode de
contamination de la prothèse, direct pendant l’intervention, par contiguïté à partir des tissus voisins ou secondairement par voie
hématogène (ou lymphatique), les micro-organismes initient la colonisation de la prothèse par un mécanisme d’adhésion bactérienne que
favorise le corps étranger prothétique. Celui-ci entraîne une réduction des défenses immunitaires locorégionales : diminution du
chimiotactisme, de la phagocytose et de l’activité bactéricide des polynucléaires neutrophiles et des macrophages. Les bactéries
rencontrent localement au contact de la prothèse un environnement favorable à leur développement même en cas de faible inoculum. De
plus, grâce à leur adhésine, ces bactéries (en particulier le staphylocoque doré) possèdent une grande affinité pour les tissus vivants et
inertes. Ces bactéries synthétisent parallèlement un biofilm (ou slime) constitué d’exopolysaccharides, à l’intérieur duquel elles se
développent. Mais leur métabolisme y est ralenti en raison de conditions nutritives médiocres. Enchâssées dans une matrice polymérique,
elles s’organisent en colonies hétérogènes dont la croissance est très ralentie dans un milieu pauvre en substances nutritives comme le
glucose. Elles sont alors protégées de l’environnement extérieur (défenses immunitaires de l’hôte, agents antibiotiques et anti-
infectieux). À partir d’une certaine densité microbienne se produit une libération de molécules de signalisation intercellulaire qui vont
activer des gènes eux-mêmes impliqués dans la production du biofilm (quorum sensing) [1,2]. Le biofilm qui adhère au matériel
prothétique, relargue de façon intermittente en surface les micro- organismes. Cela permet l’extension de la colonisation du matériel. Les
germes sont capables de coloniser le matériel inerte prothétique ou les tissus voisins et d’y survivre de façon ralentie pendant de
nombreuses années. Ils sont parfois réactivés par un traumatisme ou une intervention. On comprend ainsi schématiquement que le
traitement d’une infection sur prothèse doit être précoce si on veut espérer détruire le matériel infectant par antibiothérapie avant que
ne s’organise le biofilm protecteur. Lorsque celui-ci s’est constitué, malheureusement assez tôt, l’antibiothérapie ne sera pas ou peu
opérante et la guérison bactériologique ne pourra s’envisager qu’après ablation du matériel prothétique et excision des tissus avoisinants
infectés.
3. Germes responsables d’infection sur prothèse articulaire (Tableau 1)
Il s’agit dans la majorité des cas de staphylocoques, parmi lesquels les staphylocoques à coagulase négative (dit staphylocoques blancs)
sont majoritaires. Une résistance à l’oxacilline des staphylocoques est observée dans près de la moitié des cas (données personnelles).

Plus inquiétant encore, est l’apparition de souches de sensibilité diminuée aux glycopeptides (vancomycine, teicoplanine). Il faut
également noter la présence dans environ 10 % des cas de germes anaérobies peu pathogènes en l’absence de matériel étranger
(Propionibacterium acnes surtout, Peptostreptococcus plus rarement), et souvent considérés comme des contaminants. L’infection est
plurimicrobienne chez environ 11 % des patients.
Tsukayama 1996 (PTH) [3] Tsukayama 1999 (PTH)
[4] Desplaces 2002 (PTH, PTG)
[5]
Infections monomicrobiennes - - 86
Cocci Gram positif 74 95 74
S. aureus 22 35 25
Staphylocoques à coagulase négative 38 38 23
Streptocoques–Entérocoques 13,5 22 9
Anaérobies (P. acnes, Peptostreptococcus…) 8 - 16
Bacilles à Gram négatif 14 3 10
Entérobactéries 11 2 6
Pseudomonas aeruginosa 3 1 2
Autres - - 2
Mycobacterium tuberculosis - - 2
Infections plurimicrobiennes - - 11
Prélèvements stériles - - 3
PTH : prothèse totale de hanche ; PTG : prothèse totale de genou.
4. Conditions du diagnostic
De nombreuses classifications des infections sur prothèses ont été proposées. Certaines sont fondées sur le mode supposé d’inoculation :
per- ou périopératoire par contamination directe ou secondaire en période postopératoire, souvent tardivement, par contamination
hématogène le plus souvent à partir d’un foyer à distance. D’autres se fondent sur la date également présumée de la contamination de la
prothèse ; postopératoire immédiate ou retardée. Mais ces classifications souvent théoriques ne recoupent pas les tableaux cliniques
observés en pratique et ne permettent pas de proposer des recommandations thérapeutiques concrètes et pratiques. Or, celles-ci
doivent, en particulier, répondre à la question fondamentale qui est de déterminer s’il faut ou non changer la prothèse. C’est pour cette
raison pragmatique que nous adoptons la description de Tsukayama et al. [3,4,6], ou celle de Garvin [7] définissant ainsi quatre modes
de présentation clinique d’infection sur prothèse qui correspondent à quatre modes de prise en charge thérapeutique (Tableau 2). Ce
sont :
● l’infection postopératoire précoce (se manifestant moins d’un mois après l’intervention) ;
● l’infection chronique (se manifestant plus d’un mois après l’intervention) ;
● en général tardive, l’infection aiguë hématogène ;
● et un quatrième tableau clinique moins connu et souvent négligé, l’infection d’une prothèse que l’on pensait descellée pour des
raisons mécaniques, mais dont les prélèvements bactériologiques peropératoires systématiques réalisés en nombre (lors de son
remplacement) s’avèrent être positifs ou si la ponction préopératoire, parfois systématiquement réalisée, est positive. Il n’y a pas
de différence selon qu’il s’agisse d’une hanche ou d’un genou.
Tableau 2
Proposition de classification des infections sur prothèse d’après Tsukayama [3]
lnfection postopératoire précoce : précoce, elle se manifeste moins d’un mois après l’intervention
lnfection chronique : retardée, elle se manifeste plus d’un mois après l’intervention
lnfection aiguë hématogène : en général tardive dans un contexte bactériémique
Infection méconnue : révélée par la positivité des prélèvements bactériologiques peropératoires lors de la
reprise d’une prothèse descellée considérée comme aseptique.
4.1. L’infection postopératoire précoce
L’infection postopératoire précoce débute dans les suites immédiates de la chirurgie (moins d’un mois) : le tableau est parfois typique
caractérisé par de la fièvre, des frissons, une cicatrice inflammatoire, une articulation douloureuse et un écoulement purulent. Mais
parfois l’infection ne se traduit que par un train fébrile persistant, un hématome durable, une cicatrice qui ne se referme pas, un
écoulement persistant que le chirurgien néglige ou qualifie à tort d’infection « superficielle », un syndrome inflammatoire biologique
durable ; enfin une douleur articulaire persistante. Les germes en cause sont souvent des micro-organismes virulents comme
Staphylococcus aureus et des bacilles à Gram négatif.
4.2. L’infection chronique tardive survient plus d’un mois
après l’intervention
L’inoculation de la prothèse a pu se produire en peropératoire par l’introduction directe de bactéries cutanées peu virulentes
(staphylocoques à coagulase négative, P. acnes par exemple…) ou par inoculation hématogène à partir d’une porte d’entrée passée
inaperçue. Le diagnostic est parfois évident en présence d’une fistule siégeant à proximité d’une articulation prothésée douloureuse,
chaude et inflammatoire avec un syndrome inflammatoire biologique. Mais parfois c’est le tableau d’une prothèse « qui n’a jamais été
bien », d’une boiterie inexpliquée, d’un orifice de fistule siégeant à distance et considéré comme une lésion cutanée. Le tableau
biologique faussement rassurant (VS et CRP normales) retarde le diagnostic qui est fait par les examens tels que la scintigraphie osseuse

qui témoigne du dysfonctionnement prothétique et surtout grâce à la ponction–arthrographie avec examen bactériologique du liquide
articulaire qui permet le plus souvent à la fois de prouver le descellement, l’infection, et d’identifier le germe en cause.
4.3. L’infection (aiguë) « hématogène »
L’infection (aiguë) « hématogène » caractérise l’infection aiguë de la prothèse lors d’une bactériémie ou d’une septicémie. Le germe en
cause est souvent un S. aureus, un streptocoque β-hémolytique ou une entérobactérie. Le diagnostic d’infection de la prothèse est
parfois méconnu car le patient est souvent pris en charge en milieu médical dans un contexte septicémique parfois préoccupant mais où
l’on néglige une douleur parfois modérée de la prothèse. L’antibiothérapie efficace pour traiter une pyélonéphrite ou une pneumopathie
bactérienne sera insuffisante pour éradiquer une infection de la prothèse qui nécessiterait comme nous le reverrons une excision
chirurgicale des tissus infectés et une reprise de la prothèse en urgence suivie d’une longue antibiothérapie adaptée. Il existe une porte
d’entrée qui doit être recherchée activement et faire l’objet de prélèvements bactériologiques : cutané, urinaire, digestive, dentaire ou
pulmonaire. Le diagnostic d’une infection de prothèse au cours d’une septicémie repose sur la ponction articulaire qui doit être
systématique en cas de douleur de la prothèse.
4.4. Infection méconnue
La quatrième forme clinique correspond à la mise en évidence d’une bactérie dans plusieurs prélèvements peropératoires effectués
systématiquement lors d’un changement de prothèse dont le descellement avait été considéré comme mécanique et non septique. Les
prélèvements bactériologiques peropératoires devraient être systématiques lors de tout remplacement prothétique même si l’on pense
que le descellement n’est pas septique. Cette forme clinique souvent méconnue représente 11 % de la série de Tsukayama [3] ; elle
correspond à la pratique de notre groupe. Cinq prélèvements doivent être réalisés sur des sites différents lors du remplacement de toute
prothèse, que l’on considérera comme « étant infectée » si au moins deux d’entre eux sont positifs au même germe. Cette forme clinique
rend sans doute compte des interventions itératives de prothèses qui se descellent précocement et fréquemment sans infection évidente.
5. Diagnostic de l’infection de prothèse
S’il est souvent évident qu’une prothèse est infectée en cas de fièvre, de syndrome inflammatoire, de douleur majeure et de fistule, il est
parfois des cas où aucun des paramètres classiques de l’infection n’est positif. Le cas extrême étant celui d’une prothèse descellée dont
on ne s’aperçoit qu’elle est infectée qu’en peropératoire grâce aux prélèvements systématiques. Pour l’instant le « gold standard » reste
la réalisation des multiples prélèvements peropératoires. Et encore faut-il savoir dans certains cas critiquer un prélèvement positif en
dehors de tout autre signe d’infection et qualifier le germe isolé de « contaminant ».
5.1. Examens biologiques
L’interprétation d’une augmentation de la vitesse de sédimentation n’est pas univoque dans la période postopératoire immédiate. La C-
réactive protéine serait plus sensible mais elle est également élevée en postopératoire et met plusieurs semaines à se normaliser. La
polynucléose est souvent absente, surtout dans les cas d’infection chronique.
5.2. Examens bactériologiques
La ponction articulaire de la prothèse sous asepsie stricte et sous amplificateur de brillance permet d’analyser le liquide articulaire : des
chiffres de leucocytes supérieurs à 1700/mm3 ou un taux de neutrophiles supérieur à 65 % auraient respectivement une sensibilité
diagnostique d’infection de 94 et de 97 % et une spécificité de 88 et de 98 %. Mais cela n’est valable qu’en l’absence de maladie
inflammatoire sous-jacente (comme la PR) où le diagnostic est justement difficile [8,9]. Elle permet surtout de réaliser une analyse
bactériologique du liquide articulaire ou d’un produit de lavage–aspiration de l’articulation avec du sérum physiologique. L’arthrographie
affirme le descellement et en précise sa topographie. Elle permet, dans notre expérience, de faire la preuve d’une infection de prothèse
avant sa reprise avec une sensibilité de 83 % et une spécificité de 100 % [10]. Cette ponction que nous réalisons systématiquement
avant toute reprise de prothèse a surtout permis de poser le diagnostic d’infection dans sept cas sur 12 au sein de 66 patients chez qui
on ne suspectait pas cliniquement de surinfection du descellement, ce qui a modifié (complètement)
la stratégie de reprise de leur prothèse. Toutes les équipes n’accordent pas à la ponction préopératoire la même valeur que notre groupe,
préférant la biopsie synoviale et/ou les seuls prélèvements peropératoires. La ponction peut facilement être réalisée en salle de radiologie
par un radiologue entraîné pour la hanche comme pour le genou, articulation d’accès plus facile. Sinon elle doit être réalisée en salle
d’opération. C’est une urgence qui ne souffre aucun retard en cas de contexte septicémique. L’analyse bactériologique du liquide de
ponction et des lavages articulaires ou des prélèvements peropératoires fera l’objet d’une mise au point spécifique. Il faut cependant
insister sur l’absolue nécessité de réaliser ces prélèvements après arrêt de toute antibiothérapie depuis au moins trois semaines et sur la
faible valeur informative des prélèvements au siège d’une fistule en raison du risque de colonisation par des germes d’origine cutanée.
5.3. Analyse histologique
L’analyse histologique des prélèvements peropératoires est rarement réalisée en routine. Pourtant elle permettrait de faire un diagnostic
d’infection avec une sensibilité de plus de 80 % et une spécificité de plus de 90 % [9]. Il existe cependant d’importantes variations
interobservateurs et chez un même malade en fonction des sites prélevés. La biopsie au Tru-Cut® permet à certaines équipes de faire en
préopératoire le diagnostic d’infection de prothèse et remplace la ponction simple [11].
5.4. Examens radiographiques
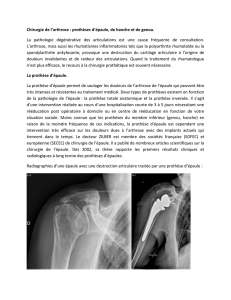
Les clichés standard peuvent apporter d’importants éléments diagnostiques en montrant des modifications chronologiques sur les clichés
successifs que l’on aura soin de comparer les uns aux autres (Figs. 1 et 2). Des appositions périostées (Figs. 3 et 4) sont
particulièrement évocatrices d’un sepsis. Il en est de même d’une zone évolutive d’ostéolyse (Figs. 5 et 6), d’une résorption de l’éperon
de Merckel et d’un enfoncement d’une des pièces prothétiques. Aucun de ces signes n’est spécifique et tous peuvent s’observer en cas de
descellement aseptique sauf peut-être la périostite qui est particulièrement évocatrice d’un processus infectieux surtout chronique. La
réalisation d’une arthrographie (Fig. 6) permet de prouver le descellement qui sera suspect d’être septique en cas d’opacification d’un
trajet fistuleux. La scintigraphie au technétium en révélant une hyperfixation pathologique lorsqu’elle persiste au-delà de la première
année après la mise en place de la prothèse, ne permet que de suspecter le descellement mais n’apporte pas d’élément suffisant pour

évoquer une cause septique. C’est pour cela que des techniques scintigraphiques utilisant d’autres traceurs telles que les leucocytes
marqués au technétium ou d’autres composants ont été proposés pour accroître la sensibilité diagnostique. Onéreuses, de réalisation
longue et parfois pénible, elles n’ont jamais fait l’unanimité sur leur emploi. L’interprétation du scanner et de l’IRM est perturbée par les
artéfacts du matériel. Le TEP couplé au scanner est en cours d’évaluation.
Fig. 1. Infection PTH à Staphylococcus lugdunensis à M2. La
radiographie est normale.
Fig. 2. Infection PTH à S. lugdunensis trois mois plus tard (M5).
Apparition d’une géode et d’appositions périostées (flèches).

Fig. 3. Infection PTG à S. epidermidis, S. lugdunernsis et
Corynébactérie. Présence d’un descellement fémoral et tibial franc et
d’appositions périostées fémorales (flèches).
Fig. 4. Infection PTH gauche à S. epidermidis. Présence d’un
descellement cotyloïdien, de géodes endostées et d’appositions
périostées fémorales (flèches). La PTH droite qui n’est pas infectée,
est indemne de lésions.
6. Traitement des infections sur prothèse articulaire
L’objectif de la prise en charge de ces infections est double : éradiquer l’infection et restaurer une fonction articulaire satisfaisante. Pour
parvenir à éradiquer une infection sur prothèse, l’association d’une identification précise du ou des germes responsables, ainsi que la
détermination de leur sensibilité aux antibiotiques, d’une excision chirurgicale rigoureuse des tissus infectés et de la totalité du matériel
étranger et d’une antibiothérapie prolongée à fortes doses est incontournable. Dans l’os infecté et en présence de matériel étranger, la
plupart des associations d’antibiotiques perdent le pouvoir bactéricide constaté in vitro dans des conditions expérimentales standardisées
[12, 13]. Plus l’excision chirurgicale est radicale, plus l’antibiothérapie sera efficace.Il faut bien distinguer les infections aiguës (évoluant
depuis moins d’un mois) et chroniques quelle que soit leur origine, postopératoire ou secondaire. Leur prise en charge qui doit rester
médicochirurgicale est totalement différente.
 6
6
 7
7
 8
8
1
/
8
100%