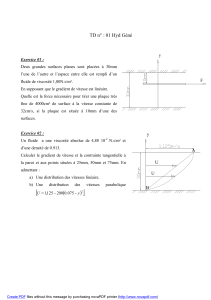
Atomistique (suite). Classification périodique.

10/22/2012
1
CHAPITRE V.
Atomistique (suite).
Classification périodique.
1
V. 1. Origines de la classification
périodique des éléments.
La notion d’élément est plus générale que celle d’atome.
Un élément chimique est caractérisé par la valeur
du numéro atomique Z (commun à l’ensemble des
isotopes qui le constituent.
numéro atomique E
ZA
17Cl35 et 17Cl37 : deux isotopes appartenant au même
élément
masse
atomique
Symbole d’un élément
2
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

10/22/2012
2
Découverte des éléments progressive:
Boyle (1627 – 1691): cite 12 éléments;
Lavoisier (1734 – 1794): mentionne 31 éléments;
1850:
60 éléments;
En 2004 : 112 éléments connus
•90 éléments (de Z = 1 à 92 (sauf Z = 43 et 61)
existent dans la nature;
•les autres ont été obtenus artificiellement par des réactions
nucléaires.
Les atomes lourds sont instables: désintégration de plus en
plus rapide lorsque Z croît.
Les derniers éléments (Bk, Cf, Es..) ont une durée de vie très
courte. 3
Analogie dans les propriétés :
vers 1830 – 1850: famille des halogènes (Cl, Br, I),
métaux alcalins (Na, K, Li);
Périodicité dans les propriétés :
vers 1860 : rangement par ordre croissant des masses
atomiques – périodicité dans les rayons atomiques, énergie
d’ionisation;
4
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

10/22/2012
3
Tableau périodique de Mendeleiev:
1869: D. I. Mendeleiev (1834-1907):
à proposé la classification des éléments au sein d’un
tableau formé de lignes et de colonnes où les
éléments ont été rangés dans l’ordre des masses
atomiques croissantes.
5
•Pour que sa classification tienne compte des familles il
n’hésita pas à inverser l’ordre de certains éléments
et à laisser des cases vides.
•les éléments étaient classés par ordre de masse
atomiques.
•les éléments ayant des propriétés semblables
étaient classés sur la même colonne.
6
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

10/22/2012
4
•Il pensait qu’on découvrirait plus tard les
éléments manquants. Il décrivit par avance les
propriétés que devraient avoir ces éléments.
•Ces éléments furent bien découverts par la suite et
ils présentaient bien les propriétés prévues.
7
8
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

10/22/2012
5
•Classification selon la valeur croissante du numéro
atomique Z;
•7 lignes –périodes et 18 colonnes – groupes;
•Les propriétés chimiques similaires se trouvent dans un
même groupe – familles des éléments.
V. 2. Classification périodique moderne.
9
Familles chimiques:
Les éléments d’une même colonne constituent ainsi un
groupe et certains ont reçu un nom particulier:
Colonne 1 : métaux alcalins;
Colonne 2 : métaux alcalino-terreux;
Colonnes 3 – 11: éléments de transition;
Colonne 16: chalcogènes;
Colonne 17 : halogènes;
Colonne 18 : gaz rares (gaz nobles, gaz inertes). 10
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%