sommaire du chapitre ii.

CH202 - Chimie Générale
1
CHAPITRE II.
REPRÉSENTATIONS DES ENTITÉS
CHIMIQUES À L’ÉTAT SOLIDE
(APPROCHE MICROSCOPIQUE DE LA
MATIÈRE)
2
A. Mehdi
SOMMAIRE DU CHAPITRE II.
II. 1. Répartition de la densité électronique dans
les cristaux;
II. 2. Entité atomique:
Modèle compact, modèle eclaté
Rayon atomique
Ion atomique
II. 3. Entité moléculaire:
Modèle compact et éclaté
Molécules discrètes, polymères
Rayon covalent, rayon de Van der Waals
Allotropie.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

CH202 - Chimie Générale
2
3
Substance cristallisée:
•Les noyaux sont à distances fixes les uns par
rapport aux autres;
•Les noyaux sont entourés par les électrons
(nuage électronique);
•Les é-s sont répartis dans tout le cristal de telle
sorte que les forces électrostatiques de
répulsion soient compensées par les forces
d'attraction.
II. 1. Répartition de la densité électronique
dans les cristaux;
Cristal:
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

CH202 - Chimie Générale
3
Il est possible de déterminer expérimentalement
la répartition de la « densité électronique »
autour des noyaux par des techniques telles que
la diffraction des rayons X.
6
Rappel :on ne considère pas un électron comme une
particule « classique » : on ne peut pas le
localiser en un point précis de l'espace !
On peut raisonner en terme de probabilité de
trouver un électron dans un élément de volume
ponctuel dV.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

CH202 - Chimie Générale
4
7
Etude de la répartition de la densité électronique
(d.é.) sur une surface
*définir un système à trois coordonnées: d.e., x et y
Probabilité faible mais
non nulle de trouver
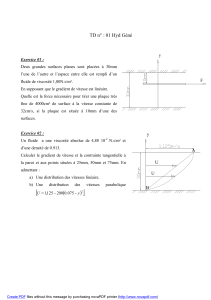
l’électron loin du noyau
8
x
y
Courbes d’isovaleurs
de la densité
électronique
Projection sur un plan
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

CH202 - Chimie Générale
5
x
y
Une autre façon de représenter cette répartition
de la densité électronique est d’utiliser la méthode
de «dégradé de gris» ou celle des pointillés.
Densité électronique
Position du noyau
Représentation de la densité électronique autour
d’un noyau
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%