Cliquez-ici pour télécharger le fichier PDF de la publication.

Neuroradiologie interventionnelle pour une pathologie vasculaire : Prise en
charge des complications immédiates et retardées.
Pr N. Bruder*, Dr O. Lévrier**
*DAR, CHU Timone, Marseille
** Service de Neuroradiologie
La radiologie interventionnelle est souvent considérée par les patients et par les anesthésistes
comme un acte anodin et sans risque du fait de l’absence d’incision large des tissus. Cette idée
optimiste des conséquences de la radiologie interventionnelle est certainement fausse. Les
complications existent comme au bloc opératoire même si elles sont parfois de nature
différente. Il ne faut donc certainement pas minimiser la prise en charge des patients et
considérer qu’un acte thérapeutique pratique en salle de radiologie est équivalent, en terme de
risques et de prise en charge anesthésique, à une intervention chirurgicale pratiquée au bloc
opératoire.
La morbidité des procédures de neuroradiologie interventionnelle est comprise entre 10 % et
20 % et la mortalité entre 1 et 4 %.(1-7). Le risque de complication dépend du type de
procédure, de la pathologie sous jacente des patients et des comorbidités principalement chez
les patients justifiant un traitement d’urgence. On peut distinguer les complications
immédiates survenant pendant le geste et les complications survenant après le réveil, dans la
grande majorité des cas pendant les 24 premières heures. Les deux principales complications
sont l’hémorragie liée à la perforation ou la rupture vasculaire et la thrombose, immédiate ou
retardée, liée à la présence de matériel endovasculaire et aux lésions de l’endothélium. Pour le
traitement des anévrysmes intracrâniens la fréquence des séquelles définitives et de la
mortalité est de 3,7 %(8). Pour les malformations artério-veineuses, la mortalité est de 1,6 %
et la morbidité de 12,8 % dans une étude(2). Les complications liées à l’anesthésie sont rares
mais certaines techniques comme l’hypotension contrôlée comportent un risque spécifique.
1 Complications immédiates
1.1 Complications hémorragiques
Le risque de rupture anévrysmale pendant le traitement endovasculaire est de 2,5 %(8,9).
Cette rupture est responsable de décès dans 1 % des cas. Le risque de rupture est plus élevé
chez les patients ayant souffert d’une hémorragie méningée préalablement au traitement,
lorsque l’anévrysme est de petite taille et lorsqu’un ballon d’occlusion artérielle temporaire

est utilisé. Cette rupture intervient le plus souvent en cours de procédure lorsque le patient est
fortement anticoagulé par de l’héparine. La gravité de cette complication résulte d’une part de
cette anticoagulation d’autre part du retard diagnostic éventuel lié à l’absence de saignement
extériorisé. En effet, chez un patient sous anesthésie générale, l’hémorragie liée à la rupture
anévrysmale se traduit par un syndrome d’hypertension intracrânienne. Les signes cliniques
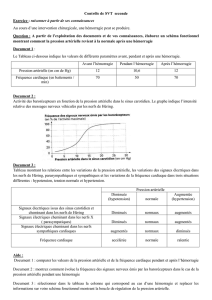
initiaux sont une poussée hypertensive sévère et une bradycardie (figure 1).
figure 1 : bradycardie lors d’un resaignement anévrysmal
Cette réaction peut être interprétée à tort comme un réveil per-anesthésique conduisant à une
attitude anesthésique inadaptée. Devant ces signes la priorité est, encore plus qu’au bloc
opératoire, de communiquer avec le neuroradiologue. L’injection de produit de contraste
permet immédiatement d’affirmer la fuite extravasculaire ou au contraire d’éliminer
l’hypothèse d’une rupture. La conduite anesthésique est schématisée dans le tableau 1(10).
Tableau 1 : prise en charge d’une hémorragie intracrânienne en salle de neuroradiologie
Immédiatement Dans un second temps
Prévenir le radiologue
Appeler de l’aide
Ventiler avec 100 % d’O2
Antagonisation immédiate de l’héparine
(1 mg de protamine pour 100 U
d’héparine)
Ne pas injecter d’antihypertenseur
Occlure l’anévrysme le plus rapidement possible
Mannitol 0,5 g/kg rapidement
Thiopental pour le contrôle de la pression
artérielle
Hyperventilation (PaCO2 26 – 30 mm Hg)
Favoriser une hypothermie modérée (34 °C)
Se préparer à un transfert au bloc opératoire
La protamine doit être prête pour permettre une antagonisation immédiate de l’héparine.
L’objectif est d’occlure le plus rapidement possible l’anévrysme pour arrêter le saignement,
tout en préservant la circulation cérébrale. Un bon moyen de limiter l’hypertension tout en

maintenant la pression de perfusion cérébrale est l’injection d’un bolus de thiopental (5
mg/kg). Le mannitol, l’hypothermie voire parfois le drainage ventriculaire externe en urgence
peuvent être indiqué pour le contrôle de l’hypertension intracrânienne. Après la procédure, la
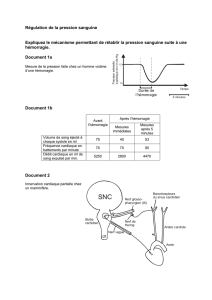
TDM cérébrale permet d’évaluer l’importance de l’hémorragie et de la fuite de produit de
contraste dans les espaces méningés (figure 2)
.Figure 2 : Importante extravasation de produit de contraste dans les espaces méningés
Lors du traitement des MAV cérébrales, le risque hémorragique prédomine dans les suites de
la procédure et est rare pendant l’embolisation. Globalement, le risque hémorragique est
estimé autour de 3 %(11). Les causes d’hémorragie sont multiples. Il peut s’agir de la rupture
d’un anévrysme de flux qui se développe sur le pédicule afférent à la MAV. Dans ce cas les
signes cliniques et l’attitude est la même que pour le traitement des anévrysmes intracrâniens.
Il peut s’agir d’une lésion traumatique par le guide ou le microcathéter. Ceci provoque en
général une hémorragie minime qui s’arrête spontanément. La rupture de la MAV pendant la
procédure peut avoir plusieurs causes. Massoud et coll.(11) individualisent 5 causes de
rupture :
- la redistribution du flux sanguin à l’intérieur du nidus de la MAV lors d’une
embolisation partielle, provoquant une augmentation de la pression à l’intérieur de
vaisseaux fragiles
- la redistribution extranidale du flux sanguin provoquant une augmentation de la
pression des vaisseaux afférents qui se transmet à la partie non occluse de la MAV
- l’extension de la diffusion de la colle utilisée pour l’embolisation aux veines de
drainage

- la stase veineuse et une thrombose veineuse retardée
- l’augmentation de la pression intravasculaire lors de l’injection du matériel
d’embolisation
L’hypotension artérielle systémique pourrait diminuer le risque hémorragique pendant la
procédure en limitant l’augmentation de la pression à l’intérieur de la MAV.
Enfin, l’hémorragie peut être liée à la rupture artérielle lors de l’angioplastie intracrânienne
réalisée pour traiter un vasospasme ou une sténose athéromateuse. Cette complication est
heureusement exceptionnelle car il n’y a aucun moyen d’arrêter l’hémorragie.
1.2 Complications thrombo-emboliques
1.2.1 Risque thrombo-embolique
Les complications thromboemboliques sont probablement les plus fréquentes des
complications graves en neuroradiologie interventionnelle. Le risque de thrombose est lié à
l’agression de l’endothélium vasculaire lors des manœuvres de cathétérisme, au produit de
contraste et au matériel d’embolisation utilisé et aux cathéters(12). Dans une revue générale
récente, le risque thrombo-embolique immédiat et retardé chez les patients bénéficiant d’une
embolisation d’un anévrysme par coils était de 8,2 %(13). Le risque est important dans les 48
premières heures puis décroît pour devenir très faible après la quatrième semaine et
probablement quasi nul après 2 mois(14). Chez les patients bénéficiant d’une angioplastie
carotidienne avec stenting, le risque de thrombose symptomatique était de 8,8 % comprenant
environ un tiers d’accidents ischémiques transitoires et deux tiers d’accidents vasculaires
définitifs. L’embolisation des MAV cérébrales était associée à un risque de thrombose de 9,4
% par procédure endovasculaire. En raison d’un nombre souvent important de procédure pour
chaque patient, le risque par patient était de 21 %. Sur les 1011 patients ayant été traités, il
apparaissait 58 accidents ischémiques transitoires et 155 accidents vasculaires cérébraux dont
62 avec une mauvaise récupération neurologique. Le risque associé à l’occlusion vasculaire
de l’artère afférente à l’anévrysme par ballon est de 19 %. Cependant, les études sur
l’occlusion endovasculaire pour le traitement des anévrysmes sont pour la plupart anciennes
et le risque actuel des procédures est probablement moins élevé.
Ces études rapportent le taux de complications symptomatiques ou de thrombose évidente
pendant la procédure. Cependant, le risque embolique lors de la procédure est certainement
plus élevé. Dans une étude utilisant l’IRM de diffusion dans les 48 heures qui suivaient le
traitement endovasculaire d’un anévrysme chez 14 patients, le taux de lésions emboliques

asymptomatiques était de 61 %. L’origine de ces accidents embolique est multiple :
dislocation d’une plaque athéromateuse pendant le cathétérisme, dissection iatrogène d’un
vaisseaux source d’embolies ultérieures, thrombus anévrysmal préexistant à la procédure,
thrombose au contact des cathéters ou des coils, injection de micro bulles d’air pendant la
procédure.
1.2.2 Prévention de la thrombose pendant la procédure
La principale méthode de prévention du risque est le maintien d’une anticoagulation efficace
pendant toute la procédure par l’héparine. Le monitorage de l’anticoagulation repose sur la
mesure du temps de coagulation activé (TC) réalisé en salle d’angiographie, 10 minutes après
l’injection d’héparine puis toutes les heures. Pour les procédures associées à une lésion
endothéliale artérielle profonde et extensive (angioplastie) ou à une stase vasculaire prolongée
(occlusion par ballon), le TC doit être compris entre 300 et 350 s car le risque thrombogène
est élevé et le risque hémorragique faible. Pour les autres procédures (embolisation d’un
anévrysme ou d’une MAV) un TC compris entre 250 et 300 s est suffisant.
L’adjonction d’un traitement antiplaquettaire au traitement par héparine diminue clairement le
risque thrombo-embolique comme cela a été démontré pour les procédure intracoronaires.
L’avantage d’associer un traitement antiplaquettaire pour diminuer le risque thrombotique est
à mettre en balance avec le risque hémorragique. L’association d’héparine, d’aspirine, et de
clopidogrel voire d’abciximab comporte un risque d’hémorragie grave(15). Ce risque est à
rapprocher des complications hémorragiques très fréquentes rencontrées au début des années
1990 avec l’association d’aspirine, de dipyridamole, de dextrans, d’héparine et
d’antivitamines K pour la mise en place de stents corononaires. Le protocole antithrombotique
doit donc être adapté à la procédure.
1.2.2.1 Embolisation d’un anévrysme par coils type GDC
Pour un traitement réalisé en urgence après hémorragie méningée, l’héparine devrait être
administrée lors du déploiement du premier coil à l’intérieur du sac anévrysmal. La dose
initiale d’héparine est de 100 U/kg initialement éventuellement augmentée pour obtenir un TC
entre 250 et 300 s. Un contrôle horaire est obligatoire pour maintenir une anticoagulation
efficace. La protamine doit être prête en cas de saignement anévrysmal. En l’absence de
complication, l’anticoagulation n’est pas antagonisée à la fin de la procédure
Pour le traitement d’un anévrysme n’ayant pas saigné, le risque hémorragique est nettement
moindre. Ceci justifie l’administration de l’héparine dès que la ponction fémorale a été
effectuée. Un traitement antiagrégeant par aspirine ou clopidogrel peut être institué avant la
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%