1er partie : Etude bibliographique de l

ECOLE NATIONALE VETERINAIRE DE LYON
Année 2007 Thèse n°
DOSAGE DE L’ACTH POUR LE DIAGNOSTIC
ETIOLOGIQUE DE L’HYPERCORTICISME CHEZ
LE CHIEN : ETUDE BIBLIOGRAPHIQUE ET
EXPERIMENTALE.
THESE
Présentée à l’UNIVERSITE CLAUDE-BERNARD – LYON I
(Médecine – Pharmacie)
et soutenue publiquement le 6 juillet 2007
pour obtenir le grade de Docteur Vétérinaire
par
TRANCHARD Amandine
Née le 16 juin 1982
A Firminy


REMERCIEMENTS
A Monsieur le Professeur ANNAT Guy de la faculté de médecine Lyon Grange
Blanche qui nous a fait l’honneur d’accepter la présidence de notre jury de thèse
A Monsieur le Professeur GARNIER François de l’Ecole Nationale Vétérinaire
de Lyon qui m’a aidé dans la réalisation et la rédaction de ce travail,
A Monsieur le Professeur BURONFOSSE Thierry de l’Ecole Nationale
Vétérinaire de Lyon qui nous a fait l’honneur de participer à notre jury de thèse,
Au Docteur PASTOR Mélanie, chargée de consultation à l’école vétérinaire de
Lyon pour son implication dans la réalisation des dosages et dans le suivi des cas
cliniques,
A toute l’équipe du laboratoire de biochimie de l’école vétérinaire de Lyon, en
particulier Edwige, pour nous avoir aidé en réalisant les dosages,
A toute ma famille, mes amis et à Pascal pour m’avoir soutenu durant mes
études et pendant la réalisation de ma thèse,
Sincères remerciements.
1

INTRODUCTION
L’hypercorticisme spontané ou syndrome de Cushing est une dysendocrinie
fréquente chez le chien. Elle est due à une cortisolémie trop élevée, soit à cause
d’une stimulation excessive des glandes surrénales par l’hypophyse soit à cause
d’une sécrétion excessive de cortisol par les glandes surrénales. Les signes cliniques
sont variés et évocateurs. Cependant, le diagnostic doit être confirmé par des
examens complémentaires avant de mettre en place le traitement. Certains tests
permettent un diagnostic de l’hypercorticisme alors que d’autres permettent d’en
déterminer l’origine. Parmi ceux-ci, le dosage de l’ACTH présente un grand intérêt.
La faible stabilité de l’ACTH rend ce test difficile à mettre en œuvre. Notre étude a
pour objectif de déterminer si ce test est utilisable en pratique courante et dans
quelles conditions.
La première partie est une étude bibliographique de l’hypercorticisme
spontané chez le chien. Dans un premier temps, nous ferons des rappels sur le
fonctionnement de l’axe corticotrope et le rôle de l’ACTH. Ensuite, nous présenterons
l’hypercorticisme avec son épidémiologie, son étiologie, ses signes cliniques, les
moyens de diagnostic et les traitements.
La deuxième partie est une étude de la stabilité de l’ACTH. Tout d’abord, nous
expliquerons la méthode de dosage utilisée. Ensuite, nous exposerons les
paramètres influençant la stabilité de l’ACTH et comment nous les avons étudiés.
Deux cas cliniques de chiens atteints d’hypercorticisme spontané seront
exposés dans la dernière partie.
2

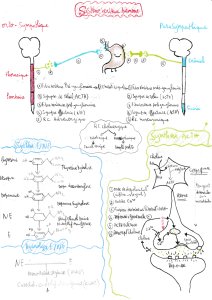
1er partie: Etude bibliographique de la sécrétion d’ACTH et de
l’hypercorticisme chez le chien--------------------------------------------------9
I) Rappels anatomiques, histologiques et fonctionnels sur l’axe
corticotrope --------------------------------------------------------------------------9
A. Rappels anatomo-physiologiques sur le système hypothalamo-hypophysaire9
1- L’hypothalamus ----------------------------------------------------------------------- 9
2- L’hypophyse---------------------------------------------------------------------------11
3- Le système vasculaire hypothalamo-hypophysaire-------------------------14
B. L’ACTH, dérivé de la proopiomélanocortine (POMC) ------------------------------14
1- Le gène de la POMC ---------------------------------------------------------------14
2- Structure de la POMC et ses dérivés-------------------------------------------15
3- Régulation de l’expression de la POMC ---------------------------------------17
4- Fonction des dérivés de la POMC-----------------------------------------------18
C. Rôle de l’ACTH dans la synthèse des glucocorticoïdes ---------------------------19
1- Synthèse des glucocorticoïdes---------------------------------------------------19
2- Régulation de l’axe corticotrope -------------------------------------------------20
3- Actions sur les glandes surrénales----------------------------------------------21
II) L’hypercorticisme chez le chien----------------------------------------- 22
A. Epidémiologie---------------------------------------------------------------------------------22
B. Etiologie----------------------------------------------------------------------------------------22
1- L’hypercorticisme d’origine hypophysaire -------------------------------------23
2- L’hypercorticisme d’origine surrénale-------------------------------------------24
3- L’hypercorticisme iatrogène-------------------------------------------------------24
C. Tableau clinique des hypercorticismes ------------------------------------------------25
1- Polyuro-polydipsie-------------------------------------------------------------------25
2- Polyphagie-----------------------------------------------------------------------------25
3- Distension abdominale-------------------------------------------------------------26
4- Faiblesse et atrophie musculaire ------------------------------------------------26
5- Signes dermatologiques -----------------------------------------------------------26
6- Anoestrus permanent et atrophie testiculaire---------------------------------28
7- Signes neurologiques---------------------------------------------------------------28
8- Obésité---------------------------------------------------------------------------------28
9- Signes respiratoires-----------------------------------------------------------------28
10- Paralysie faciale--------------------------------------------------------------------29
11- Syndrome de dégénérescence acquise de la rétine ----------------------29
D. Les complications de l’hypercorticisme------------------------------------------------29
1- Les infections urinaires et les urolithiases-------------------------------------29
2- Le diabète sucré ---------------------------------------------------------------------30
3- L’hypertension systémique--------------------------------------------------------30
4- Les pancréatites aiguës------------------------------------------------------------30
5- L’insuffisance cardiaque congestive --------------------------------------------31
6- Les glomérulonéphrites ------------------------------------------------------------31
7- Les thromboembolies pulmonaires----------------------------------------------31
E. Diagnostic -------------------------------------------------------------------------------------31
1- Examens d’orientation--------------------------------------------------------------31
3
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
1
/
89
100%