culture-qualité Recommandations pour l`exécution et l`interprétation

culture-qualité
Recommandations pour l’exécution
et l’interprétation du test de la sueur
Sweat testing: review of technical requirements
M. Rota
1
T. Nguyen-Khoa
2
M. Marchand
3
D. Feldmann
4
J. Dumont
5
D. Khalfon
6
A. Vassault
7
J.-P. Borgard
1
Groupe de travail « Test de la
sueur » du Collège national de
biochimie des hôpitaux (CNBH).
Coordonnateur M. Rota
1
Service de biochimie, CHI de Créteil
2
Service de biochimie A,
CHU Necker-Enfants Malades AP-HP,
Paris
3
Service de biochimie,
CHU Robert Debré AP-HP, Paris
4
Service de biochimie,
CHU Armand Trousseau AP-HP, Paris
5
Service de biochimie
CH Le Raincy-Montfermeil, Montfermeil
6
Service de biochimie,
CH Victor Dupouy, Argenteuil
7
Asqualab, Hôpital Broussais, Paris
Article reçu le 22 septembre 2007,
accepté le 11 janvier 2008
Résumé.Le test de la sueur consiste à mesurer la concentration sudorale en
chlorure. Il constitue un examen clé pour conforter ou récuser le diagnostic de
mucoviscidose. Du fait de son exécution délicate, son interprétation doit
s’appuyer sur des arguments biologiques, cliniques et génétiques. Les recom-
mandations que nous proposons ont été établies afin d’harmoniser les pratiques
de ce test. Elles sont élaborées de façon consensuelle par des biologistes
membres des Centres de ressources et de compétences pour la mucoviscidose
et/ou du groupe de travail « Test de la sueur » du Collège national de biochimie
des hôpitaux, en fonction de l’état actuel des connaissances sur le sujet, de
l’expérience des praticiens et des recommandations établies aux Etats-Unis et
en Grande-Bretagne.
Mots clés :test de la sueur, mucoviscidose, chlorure, conductimétrie,
iontophorèse à la pilocarpine, dépistage néonatal
Abstract.The sweat test, a quantitative measurement of chloride in sweat,
remains a key laboratory test to support the diagnosis of cystic fibrosis. Howe-
ver, because of its delicate execution, sweat test result should be interpreted
with biological, clinical and genetic arguments. The following guidelines
which we propose, were established in order to harmonize the practices of the
sweat test. They are elaborated in a consensual way by biologists from cystic
fibrosis reference centers and/or from the working group “Sweat Testing” of
the National College of Biochemistry Hospital praticiens, according to the
current state of knowledge on the subject, the experiment of the biologists and
the recommendations established in the United States and in the United Kin-
gdom.
Key words:sweat test, cystic fibrosis, sweat chloride, iontophoresis,
conductimetry, newborn screening
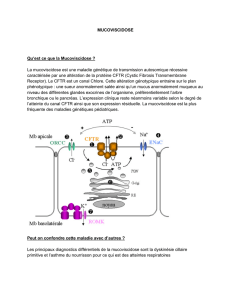
La concentration de l’ion chlorure (Cl
-
) dans la sueur est
élevée chez les patients atteints de mucoviscidose ou
fibrose kystique du pancréas (CF). Cette élévation est due
à l’absence ou l’altération de la fonction de la protéine
CFTR (cystic fibrosis transmembrane conductance regu-
lator) entraînant une diminution de la réabsorption de Cl
-
par les canaux des cellules épithéliales des glandes
sudoripares.
Le test de la sueur consiste à doser l’ion Cl
-
, directement
ou indirectement, dans la sueur recueillie après stimula-
tion par iontophorèse à la pilocarpine. Ce test, de réalisa-
tion délicate, constitue l’examen clé pour conforter ou
récuser le diagnostic de mucoviscidose. Il présente une
sensibilité de 98 %, une spécificité de 83 % et une valeur
prédictive positive de 99,5 % [1]. Depuis 2002, le dépis-
tage néonatal de la mucoviscidose est systématique en
France. Il associe successivement en cas de positivité, le
dosage de la trypsine immuno-réactive (TIR), la recherche
de mutations dans le gène CFTR et le test de la sueur [2].
Tirés à part : M. Rota
abc
Ann Biol Clin 2008 ; 66 (2) : 221-7
doi: 10.1684/abc.2008.0214
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008 221
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Le test de la sueur est une analyse de biologie médicale
inscrite à la nomenclature des actes de biologie médicale
(NABM) et sa réalisation est soumise au respect du Guide
de bonne exécution des analyses (GBEA) [3]. Son exécu-
tion partielle ou totale dans les services de soins, doit
suivre les modalités d’une analyse de biologie médicale
délocalisée [4].
L’objectif de cette revue est d’aider les praticiens dans le
choix de la technique et de son application, y compris
dans le cadre du dépistage néonatal de la mucoviscidose,
et d’harmoniser sa pratique en France. Ces recommanda-
tions sont élaborées de façon consensuelle par des biolo-
gistes membres des Centres de ressources et de compéten-
ces pour la mucoviscidose (CRCM) et/ou du groupe de
travail « Test de la sueur » du Collège national de biochi-
mie des hôpitaux (CNBH), en fonction de l’expérience
des praticiens [5], de la réactualisation des connaissances
sur le sujet depuis la mise en place en France du dépistage
néonatal systématique, et des recommandations établies
dans d’autres pays [6, 7]. Le respect de ces recommanda-
tions conditionne la qualité du test de la sueur qui déter-
mine le diagnostic de la maladie.
Le test de la sueur
Le test de la sueur se décompose en plusieurs étapes de
l’accueil du patient jusqu’à la transmission des résultats.
Chaque étape est détaillée ci-après pour apporter toutes les
informations utiles pour assurer la qualité du test.
Prise de rendez-vous, informations
et conditions requises
Le test de la sueur doit être effectué sur rendez-vous,
assurant ainsi la présence et la disponibilité des personnes
compétentes.
Informations à recueillir
Lors de la prise de rendez-vous, il sera noté l’identité du
patient, son âge et son poids (s’il est connu) pour les
nouveau-nés. Un numéro de téléphone des parents sera
demandé. Dans le cadre du dépistage néonatal, le nom du
bébé peut être différent entre le premier dosage de TIR et
le test de la sueur. Il est important de s’en assurer.
Le médecin prescripteur sera identifié avec ses coordon-
nées et la raison de sa prescription.
S’informer sur une éventuelle pathologie contagieuse afin
d’organiser le déroulement du test dans un local où ne
seront pas reçus les autres consultants.
Informations à communiquer
Informer précisément du lieu du test et du circuit adminis-
tratif à effectuer dans l’établissement.
Demander à ne pas mettre de produits (lait de toilette,
lotions, crèmes, etc.) sur les bras et les jambes de l’enfant,
la veille et le jour de l’examen.
Informer de la durée approximative du test.
S’informer d’un traitement corticoïde pour prévoir la pos-
sibilité d’une fenêtre thérapeutique.
Expliquer brièvement le déroulement du test : la personne
qui accueille, les différentes étapes de stimulation et
recueil, la non douleur, l’absence de besoin d’être à jeun
(le nourrisson pourra même prendre son biberon si néces-
saire pendant le test).
Informations aux parents et aux patients
Préalablement à l’exécution du test, une note d’« Informa-
tion aux patients » précisant le déroulement du test, sera
donnée à lire au patient (adulte) ou aux parents (enfants).
D’autres informations pourront être données oralement,
notamment sur les phénomènes pouvant être observés
(chaleur, picotements, rougeur, etc.).
Dans le cadre du dépistage néonatal systématique de la
mucoviscidose, il est nécessaire que les parents aient un
entretien préalable au test avec le médecin du CRCM afin
d’expliquer pourquoi ce test est effectué [7]. Dans la
mesure du possible, cet entretien doit immédiatement pré-
céder le test et être poursuivi après la transmission du
résultat pour apporter aux parents tous les commentaires
et explications de celui-ci.
Age de l’enfant
La concentration en électrolytes de la sueur est élevée
pendant les premiers jours de vie [8]. La réalisation du test
se heurte à la nécessité de recueillir un volume ou de
s’assurer d’un débit de sueur suffisant en fonction des
équipements utilisés. C’est pourquoi le test pourra être
pratiqué chez l’enfant lorsqu’il aura atteint le poids de
3,5 kg et qu’il sera âgé de plus de 3 semaines.
Chez le prématuré, au cours des 14 premiers jours de vie,
la concentration sudorale du chlorure est élevée ou varia-
ble. Le test sera pratiqué, comme chez l’enfant à terme,
c’est-à-dire lorsqu’il aura atteint le poids de 3,5 kg.
Contre-indications
D’une façon générale, le test devra être différé chez un
enfant en mauvais état général et plus particulièrement si
l’enfant est déshydraté ou dénutri, en cas d’œdème, en cas
d’eczéma au lieu du recueil de la sueur [9].
Des précautions sont à prendre si l’enfant est fiévreux et
lors de traitements par les corticostéroïdes. L’antibiothéra-
pie n’est pas une contre-indication, notamment avec les
bêtalactamines dont la flucloxacilline orale [9].
culture-qualité
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008222
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Réalisation du test de la sueur
Stimulation de la sécrétion de sueur
La stimulation de la sudation devra se faire par une
méthode standardisée de iontophorèse à la pilocarpine.
Les méthodes de recueil de la sueur sans stimulation sont
strictement à proscrire à cause des échanges ioniques
intervenant au cours du recueil et des risques encourus par
l’enfant.
Recommandations générales
Les doigts de l’opérateur ne doivent pas toucher la zone de
peau sur laquelle le test est effectué, ainsi que sur les
différents systèmes de stimulation et recueil.
La zone à stimuler est la peau saine de l’avant-bras, le
bras, la cuisse ou le mollet. En cas de difficultés prévisi-
bles de sudation, en particulier pour les enfants de peau
noire ou les patients sous oxygène, la stimulation peut être
réalisée après abrasion préalable de la peau : alternance
compresses sèches et humides, utilisation d’un gant de
crin ou d’un rasoir à usage unique. L’éther est à exclure.
L’alcool à 60° qui dégraisse la peau impose ensuite un
nettoyage soigneux à l’eau désioninsée.
Nettoyer soigneusement la zone à stimuler à l’eau désioni-
sée puis sécher à l’aide de compresses dont on a vérifié au
préalable qu’elles ne relarguent pas de chlorure.
Ne pas pratiquer 2 stimulations en même temps. Si la
stimulation est renouvelée, les zones ne doivent pas se
chevaucher. Ne pas effectuer plus de 2 stimulations dans
la même journée.
Il faut posséder plusieurs tailles d’électrodes pour s’adap-
ter au mieux à la zone à stimuler. Les électrodes doivent
être fermement maintenues pendant la stimulation pour
garder le contact électrique mais ne doivent pas être en
contact direct avec la peau au risque de provoquer des
brûlures.
Les électrodes doivent toujours être placées sur le même
membre (le courant ne doit jamais traverser le cœur).
Systèmes de stimulation
L’appareil de stimulation doit être exclusivement sur bat-
teries.
La stimulation est semi-manuelle (appareil galvanique
255, Elion, Montrouge, France) ou entièrement automati-
sée (systèmes Exsudose
®
(TEM, Lormont, France), Wes-
cor Macroduct
®
ou Nanoduct
®
(J2L Elitech, Salon de Pro-
vence, France).
Appareil Galvanique 255 Elion
Le générateur est relié à des électrodes en étain de 55 x
35 mm ou de carbone de 30 mm de diamètre recomman-
dées pour les enfants de petit poids. Ces électrodes sont
placées dans des gants hydrophiles imprégnés de solution
de nitrate de pilocarpine à 2 g/L pour l’anode et de solu-
tion de H
2
SO
4
0,04 N pour la cathode. La traçabilité de la
préparation de ces solutions doit être exhaustive. L’inten-
sité du courant est ajustée progressivement à la valeur
limite de 4 mV et maintenue pendant 5 minutes.
Système Microstim Exsudose
®
Le système de stimulation contient des compresses à
usage unique imprégnées de solution de pilocarpine
(anode) ou de solution de K
2
SO
4
(cathode). Le système
est placé sur le bras et maintenu par un brassard. Le cou-
rant délivré est de 1 mV pendant 15 minutes. Un témoin
lumineux permet de contrôler le bon déroulement de l’ion-
tophorèse.
Système Wescor Macroduct
®
Des électrodes de 30 mm de diamètre, contenant des dis-
ques de gel imprégnés de pilocarpine (0,5 %) sont placées
sur l’avant-bras et maintenues par des bracelets en velcro
ou en caoutchouc. Elles sont reliées au stimulateur (3700
Webster sweat inducer
®
). La stimulation est automatique-
ment arrêtée lorsque l’intensité totale (1,5 mA pendant
5 min 30) a été délivrée.
Système Wescor Nanoduct
®
Les 2 supports à électrodes sont installés sur l’avant-bras à
l’aide de bracelets caoutchouc. Les disques de gel impré-
gnés de pilocarpine (1,5 %) sont insérés dans les électro-
des de 18 mm de diamètre et celles-ci fixées aux supports.
L’iontophorèse est arrêtée automatiquement quand
l’intensité totale a été délivrée (0,5 mA pendant 2 minu-
tes).
Recueil de la sueur
Après la stimulation, la peau de la zone stimulée doit être
nettoyée largement à l’eau distillée et séchée. Un système
de recueil sera placé à l’endroit de la zone stimulée
(cathode, pôle rouge).
Recommandations générales
Pendant et après le recueil il faut éviter l’évaporation et la
contamination de la sueur produite. Tout contact direct
entre les surfaces du système de recueil appliquées sur la
peau et les mains de l’opérateur est à proscrire.
Systèmes de recueil utilisés en France
Les systèmes de recueil diffèrent en fonction de la techni-
que de dosage utilisée.
Papier-filtre (en vue du dosage titrimétrique) sans
chlorure de type papier Whatman sans cendre n° 40/42/44
(VWR, Fontenay-sous-Bois, France). Le disque est replié
en 2 et coupé pour avoir environ la taille de l’électrode,
puis taré à 0,1 mg près dans un erlenmeyer couvert d’un
Parafilm
®
. Le papier ainsi préparé, est placé délicatement
sur la zone stimulée et protégé de l’évaporation par un
plastique imperméable de type Parafilm
®
. Il sera fixé her-
métiquement avec du sparadrap hypoallergénique.
Test de la sueur
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008 223
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Le recueil est poursuivi jusqu’à ce que le papier soit
imbibé. La durée est de l’ordre de 30 minutes à 1 heure en
fonction du courant délivré pendant l’iontophorèse.
Exsupatch
®
(en vue de dosage par électrode sélective
Exudose
®
). Il est placé orifice ouvert sur la zone stimulée.
Par sa forme en cupule, il a pour but de concentrer les
gouttelettes de sueur sur la peau. Il est protégé et fixé par
une bande de Parafilm
®
. La durée de recueil est de
15 minutes.
Collecteur Macroduct
®
(en vue de dosages conducti-
métrique, coulométrique ou potentiométrique). Le col-
lecteur capillaire est placé sur la zone stimulée et main-
tenu par un bracelet caoutchouc ou par une bande de
Parafilm
®
. Une tâche de colorant bleu sur le collecteur
permet de visualiser la sueur qui pénètre par capillarité
dans le collecteur et d’en apprécier à tout moment le
volume. La durée moyenne de recueil est de 20 à 30
minutes.
Nanoduct
®
(en vue d’un dosage conductimétrique).
L’anode et son gel sont retirés et remplacés, après lavage et
séchage de la peau, par la cellule permettant le recueil et la
mesure. La production de sueur est automatiquement
contrôlée. La mesure ne sera automatiquement effectuée
que lorsque le débit a atteint 1 g/m
2
/min entre3à5minutes.
Quantité de sueur minimale requise
La quantité de sueur recueillie doit être suffisante pour
aboutir à une composition stabilisée en électrolytes et
obtenir une précision suffisante lors du dosage (coefficient
de variation CV < 5 %). En cas de prélèvement de sueur
insuffisant, il est conseillé de réaliser une nouvelle ionto-
phorèse sur une zone cutanée différente de la première et
préalablement abrasée. Deux prélèvements de sueur insuf-
fisants ne devront pas être mélangés pour le dosage puis-
que le débit de sueur sécrété n’aura pas été suffisant. Un
autre test devra être effectué à distance.
Le débit de sueur doit être d’au moins 1 g/m
2
/min (poids
de sueur/surface de peau/temps de recueil). La quantité de
sueur est calculée pour chaque système.
Papier-filtre : avec des électrodes de 55 x 35 mm, 57 mg
de sueur seraient nécessaires, et avec des électrodes de
30 mm de diamètre, 14 mg de sueur. Cependant, pour
obtenir une précision de dosage suffisante après élution de
la sueur à partir du papier-filtre, la quantité minimale de
sueur recueillie sur papier est fixée à 60 mg.
Exsupatch
®
: la taille de la cupule étant de 12 x 30 mm,
10 lL de sueur sont nécessaires.
Collecteur Macroduct
®
: le diamètre du collecteur étant
de 2,8 cm, 3 spires minimum de sueur sont requises
(20 lL)
Nanoduct
®
: le débit de production de la sueur est contrôlé
automatiquement avant la mesure.
Recueil de sueur
Papier-filtre : Le papier-filtre imprégné de sueur est récu-
péré délicatement et rapidement replacé dans son erlen-
meyer préalablement taré et refermé hermétiquement.
L’ensemble est repesé à 0,1 mg près. La sueur est ensuite
éluée dans un volume de 10 mL d’eau distillée pendant 20
à 30 minutes en exprimant fortement le papier-filtre.
Exsupatch
®
: Il ne permet pas de quantifier le volume de
sueur. En cas de concentrations de chlorures dans la sueur
supérieures aux valeurs usuelles ou en cas de discordance
avec les résultats attendus en fonction de la biologie molé-
culaire, il sera associé à une autre méthode quantitative.
Collecteur Macroduct
®
en fonction du mode de dosage :
– la sueur est transférée du capillaire directement dans la
cellule de mesure conductimétrique ;
– la sueur est transférée du capillaire dans un godet fermé
et taré en vue d’un dosage coulométrique de l’ion chlo-
rure. La prise d’essai après homogénéisation est de 20 lL
(soit environ 20 mg de sueur).
– les dosages conductimétrique et coulométrique peuvent
être effectués l’un après l’autre sur le même prélèvement
homogénéisé.
Nanoduct
®
: la quantité de sueur requise est validée auto-
matiquement.
Dosage de l’ion chlorure de la sueur
La méthode doit être sensible entre 5 et 150 mmol/L de
chlorure et le CV de la méthode doit être inférieur ou égal
à 5 % pour une concentration moyenne de 40 mmol/L de
chlorures ou 60 mmol équivalent chlorure de sodium
(NaCl)/L.
Dosage de l’ion chlorure seul
Les résultats sont exprimés en mmoles de chlorure par
litre.
Titrimétrie au nitrate mercurique par la technique de
Schales et Schales [5]. Lors du recueil de la sueur sur
papier l’élution impose une dilution de l’ordre du 1/100 et
cette technique dosant la totalité des ions Cl
-
est alors
recommandée. Une calibration devra être effectuée entre 5
et 150 mmol/L et un blanc sera effectué à chaque série afin
de vérifier l’absence de chlorure dans les réactifs et le
papier-filtre. La pesée doit être aussi rapide que possible
après le recueil et effectuée à l’aide d’une balance précise
à 0,1 mg près. Les modalités varient entre les sites en
fonction des récipients utilisés, des concentrations des éta-
lons, des concentrations, nombres et prises d’essai des
contrôles.
Coulométrie (Chloridomètre 926 Sherwood (Dutscher,
Brumath, France)). La calibration est effectuée avec un
étalon du commerce à 100 mmol/L de chlorure. La prise
d’essai est de 20 lL de sueur.
culture-qualité
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008224
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.

Electrochimie à l’aide d’une électrode sélective Exsu-
dose
®
. L’électrode est reconditionnée 45 minutes avant le
dosage ou la série de dosages. Une calibration en 3 points
est effectuée. Le dosage est réalisé par contact de l’élec-
trode avec la goutte de sueur collectée.
Potentiométrie directe ou indirecte : ces techniques
bénéficient de leur application sur des automates multipa-
ramétriques. L’inconvénient en est souvent le volume
important d’échantillon nécessaire.
Dosage indirect par conductimétrie
Les résultats sont exprimés en mmoles équivalent NaCl
par litre.
Cette méthode dose l’ensemble des ions de la sueur.
Macroduct
®
Sweat check Wescor (Elitech). Après
homogénéisation, la sueur est aspirée dans la cellule de
mesure propre et sèche à l’aide d’une seringue. Après la
mesure, l’échantillon peut être récupéré pour un dosage de
chlorure en coulométrie ou en potentiométrie. L’étalon-
nage sera effectué en cas de dérives des contrôles.
Nanoduct
®
Wescor (Elitech). La mesure de conductivité
est faite in situ sur une quantité minime de sueur. La
calibration électrique sur un point à 80 mmol/L est obliga-
toire à chaque série de dosage. Le débit est mesuré et s’il
atteint 1 g/m
2
/min, le résultat est affiché une fois la
conductivité stabilisée. Il est nécessaire de posséder le
système Patient Simulator
®
Wescor (Elitech) pour réaliser
le dosage des solutions contrôles.
Contrôle de qualité
Contrôle interne
Une solution de contrôle contenant des chlorures doit être
dosée avant chaque série de tests. Le résultat ne devra pas
s’écarter de plus de 5 % de la valeur moyenne. La concen-
tration de cette solution contrôle devra être choisie proche
de la valeur seuil inférieure pour la technique utilisée. Les
solutions de contrôle utilisées doivent être différentes des
solutions de calibration.
Contrôle externe
Un contrôle de qualité national devrait être organisé pro-
chainement.
Un CQ externe bisannuel concernant le dosage du chlo-
rure dans la sueur est organisé par Asqualab
®
.Ilest
recommandé que chaque laboratoire participe à un
contrôle de qualité externe.
Lors de l’utilisation du système Nanoduct
®
, un module
complémentaire est nécessaire pour le dosage des solu-
tions de contrôles (module Patient Simulator
®
Wescor).
Interprétation
Les valeurs seuils et usuelles diffèrent entre le dosage de
l’ion Cl
-
seul et celui des ions de la sueur [10, 11].
Valeurs usuelles et seuils
Les valeurs présentées sont celles de la NCCLS (National
commitee for clinical laboratory standards) commentées
en 2007 [10]. Elles sont à interpréter en fonction de l’âge
et du phénotype.
Ion chlorure (titrimétrie, coulométrie, électrochimie ou potentiométrie)
Valeurs usuelles < 40 mmol/L
Valeurs intermédiaires 40 à 60 mmol/L
Valeurs pathologiques > 60 mmol/L
Chez les jeunes enfants (< 3 mois) et dans le cadre du
dépistage néonatal de la mucoviscidose, des valeurs supé-
rieures à 30 mmol/L de chlorure seraient à prendre en
compte et nécessiteraient de poursuivre l’exploration.
Ions sudoraux (conductimétrie)
Valeurs usuelles < 60 mmol/L équivalent NaCl
Valeurs intermédiaires 60 à 90 mmol/L équivalent NaCl
Valeur pathologique > 90 mmol/L équivalent NaCl
Interprétation
Les valeurs seuils de l’ion chlorure sont bien établies et le
dosage de cet ion est recommandé dans les centres de
référence.
Des études sont en cours pour établir précisément les
valeurs seuils des techniques de dosage par conductimé-
trie [11]. L’une d’elles, menée par le groupe de travail du
CNBH, sur la comparaison de 753 valeurs obtenues en
coulométrie et conductimétrie montre que le seuil patholo-
gique de 60 mmol/L de chlorure correspondrait à une
valeur de 87 mmol équivalent NaCl/L et que la limite
inférieure de la zone d’incertitude serait de 66 mmol équi-
valent NaCl/L pour une valeur de 40 mmol/L de chlorure.
En l’attente, pour des résultats > 60 mmol/L équivalent
NaCl (seuil inférieur de la zone d’incertitude NCCLS)
chez le nouveau-né et en cas de discordance avec les
résultats de biologie moléculaire, il est recommandé de
pratiquer un dosage spécifique de l’ion chlorure dans la
sueur. En 2007, la Cystic fibrosis foundation [10] a
approuvé l’utilisation de la conductimétrie pour le dépis-
tage et préconise que les enfants dont les résultats sont
supérieurs à 50 mmol/L dans cette technique, soient adres-
sés à un centre de référence pour un dosage de chlorure.
Dans le cadre du dépistage systématique néonatal, il est
préconisé d’avoir deux résultats de test de la sueur. Dans
tous les cas, un deuxième test est recommandé lorsque le
résultat n’est pas celui attendu par le phénotype et/ou le
génotype [7].
Tout résultat anormalement élevé (> 150 mmol/L de chlo-
rure) devra faire rechercher un problème de contamination
ou un problème analytique.
Test de la sueur
Ann Biol Clin, vol. 66, n° 2, mars-avril 2008 225
Copyright © 2017 John Libbey Eurotext. Téléchargé par un robot venant de 88.99.165.207 le 03/06/2017.
 6
6
 7
7
1
/
7
100%