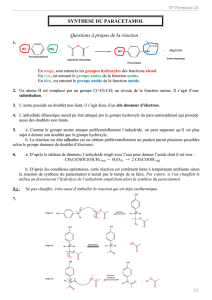
Cahier de texte Incertitudes et écriture des résultats

Cahier de texte
Date :semaine 36
Incertitudes et écriture des résultats
1)Chiffres significatifs
1.1)Détermination du nombre de chiffres significatifs
Dans un nombre, les chiffres autres que zéro sont significatifs. Les zéros s’ils sont placés en tête du
nombre ne sont pas significatifs.
Exemples : 6,8 2 chiffres significatifs 6,80 3 chiffres significatifs
6800 4 chiffres significatifs 0,68 2 chiffres significatifs
1.2)Chiffres significatifs et précision
Si on ne dispose pas d’information concernant la manière dont les nombres sont obtenus, le
nombre de chiffres significatifs indique la précision. Par convention, on considérera que le dernier
chiffre significatif est connu à ±0,5.
Exemples :
Écrire m=11,597 kg signifie que 11,5975 kg> m >11,5965 kg
Écrire m=11,60 kg signifie que 11,605 kg> m >11,595 kg
Écrire m=11,6 kg signifie que 11,65 kg> m >11,55 kg
Attention : lors de conversions d’unités ou de passage d’unités à leurs multiples ou sous multiples, il
faut veiller à la conservation du nombre de chiffres significatifs.
Exemples :
m=11,6 kg = 11,6.103 g (3 chiffres significatifs) mais pas 11600 g (5 chiffres significatifs)
V=2,75 m3 = 2,75 106 mL mais pas 2 750 000 L
1.3)Présentation du résultat d'un calcul
Il faut arrondir le résultat obtenu par un calcul afin d’exprimer le résultat avec une précision égale à
celle de la donnée utilisée la moins précise.
Pour une addition ou une soustraction, le résultat ne doit pas avoir plus de décimales que la
donnée qui en a le moins.
Pour une multiplication ou une division, le résultat ne doit pas avoir plus de chiffres significatifs que
la donnée qui en a le moins.
Exemple :
25,42 X 72,5
=
1,84.103
4 chiffres significatifs 3 chiffres significatifs 3 chiffres significatifs
1.4)Arrondi
Un arrondi d'un nombre est une valeur approchée de ce nombre obtenue, à partir de son
développement décimal, en réduisant le nombre de chiffres significatifs.
Par exemple 73 peut être arrondi à la dizaine la plus proche en 70, parce que 73 est plus proche de
70 que de 80.
Méthode :
•Choisir le dernier chiffre (à la droite) à conserver.
•Augmenter ce chiffre d'une unité si le chiffre suivant vaut au moins 5 (« arrondissage par
excès »)
•Conserver ce chiffre si le suivant est strictement inférieur à 5 (« arrondissage par défaut »)
Exemples :
3,046 arrondi aux centièmes vaut 3,05 (le chiffre suivant (6) est supérieur à 5).
Voici d'autres exemples en ne gardant qu'un seul chiffre significatif après la virgule :
1,349 devient 1,3 (car le chiffre suivant 3 est strictement inférieur à 5)
1,350 devient 1,4 (car le chiffre suivant 3 vaut au moins 5)
En pratique, la méthode consiste à séparer les dix chiffres décimaux (0, 1... 9) en deux parties :

les cinq premiers : 0, 1, 2, 3 et 4, pour lesquels on passe à la valeur inférieure ;
les cinq suivants : 5, 6, 7, 8 et 9, pour lesquels on passe à la valeur supérieure.
Cette méthode limite l'accumulation d'erreurs lors de calculs successifs.
2)Écriture des résultats
L’écriture du résultat du mesurage doit intégrer l’incertitude, le niveau de confiance et s’écrire avec
les unités appropriées :
M=m±ΔM , unité , niveau de confiance
La précision sur le résultat du mesurage sera caractérisée par
ΔM
M
Cette précision est souvent
exprimée en %. Plus le résultat est petit, plus le mesurage est précis.
La dernière étape consiste à déterminer le nombre de chiffres significatifs de m et de ΔM.
Pour l’incertitude, obtenir une précision plus petite que 10% correspond à des conditions de mesure
très contraignantes et coûteuses. Dans la très grande majorité des cas, il faut donc limiter le
nombre de chiffres significatifs de l’incertitude à un seul chiffre significatif.
Exemples
On mesure r= 100,251389 Ω avec une incertitude ΔM= 0,812349 Ω. On écrit alors le résultat sous
la forme
R=(100,3±0,8)Ω
Exercice 1:
L’étiquette d’un sachet d’aspirine prescrit au titre de la prévention des AVC porte la mention :
« Teneur en aspirine : 100 mg » Un élève se propose de vérifier la teneur en aspirine, notée HA, de
ce sachet.
Pour cela, il prépare une solution S en introduisant l’aspirine contenue dans le sachet dans une
fiole jaugée, puis en ajoutant de l’eau distillée pour obtenir une solution de volume 500,0 mL.
Il prélève ensuite un volume VA = (100,0 +/- 0,1) mL de cette solution S qu’il dose avec une solution
aqueuse d’hydroxyde de sodium
(Na(aq)
+, HO(aq)
-)
de concentration molaire
CB=(1,00±0,02).10-2 mol.L-1
en présence de phénolphtaléine. Le volume VE de solution aqueuse
d’hydroxyde de sodium versé pour atteindre l’équivalence est VE = 10,7 +/- 0,1 mL.
1)Déterminer la masse mexp d’aspirine ainsi déterminée.
A l'équivalence on peut écrire :
CA.VA=CB.VE
CA=CB.VE
VA
=1,00.10-2 x10,7.10-3
100,0.10-3 =1,07.10-3 mol.L-1
nA=CAx V fiole=1,07 .10-3 x500,0 .10-3=5,35.10-4 mol
mA=nAx M aspirine=5,35 .10-4 x180=96,3.10-3 g=96,3mg
2)Déterminer l’incertitude relative
Δmexp
mexp
dont on admet que, dans les conditions de l’expérience,
la valeur est donnée par la relation :
(Δmexp
mexp
)²=( ΔV E
VE
)²+( ΔC B
CB
)²
En déduire un encadrement de la masse mexp obtenue par l’élève.
(Δmexp
mexp
)²=( ΔV E
VE
)²+( ΔCB
CB
)²
Δmexp
mexp
=
√
(ΔV E
VE
)²+( ΔC B
CB
)²=
√
(0,1
10,7)²+( 0,02
1)²=2%
Δmexp=mexp .
√
(ΔV E
VE
)²+( ΔC B
CB
)²=2%.mexp=2mg
94mg<mexp<98mg

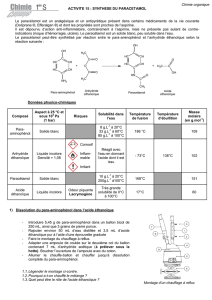
Exercice 2 :
La mesure de la résistance thermique du verre est réalisée 12 fois, dans les mêmes conditions
expérimentales. Les valeurs obtenues, exprimées avec l'unité du système international, sont
rassemblées dans le tableau suivant :
n 1 2 3 4 5 6 7 8 9 10 11 12
Résistance
thermique 0,81 0,89 0,78 0,82 0,87 0,78 0,76 0,92 0,85 0,84 0,81 0,79
Soient
̄
RTh
la moyenne des n mesures réalisées et
U(RTh)
l'incertitude de mesure
correspondante, associée au niveau de confiance de 95 %.
Par définition :
U(RTh)=t95 .σn−1
√
n
t95
est appelé coefficient de Student. Pour n=12 et pour un niveau de confiance choisi de 95%,
t95=2,20
.
σn−1
désigne l'écart-type expérimental, défini par :
σn−1=
√
1
n−1.∑
k=1
n
((RTh)k−̄
RTh)²
Écrire le résultat de la mesure expérimentale de
RTh
correspondant à un niveau de confiance de
95%.
Afin d’écrire le résultat de la mesure correctement, il faut déterminer l’incertitude U(RTh).
On écrira
RTh=̄
RTh±U(RTh)
Calcul de la moyenne :
̄
RTh=
∑
k=1
n
(RTh)k
n=0,81+0,89+0,78+0,82+0,87+0,78+0,76+0,92+0,85+0,84+0,81+0,79
12 =0,827 K.W -1
Calcul de l’écart-type expérimental :
σn−1
σn−1=
√
1
11 .[(0,81-0,83)²+(0,89-0,83)²+(0,78-0,83)²+(0,82-0,83)²+(0,87-0,83)²+(0,78-0,83)²}+(0,76-0,83)²+
(0,92-0,83)²+(0,85-0,83)²+(0,84-0,83)²+(0,81-0,83)²+(0,79-0,83)²]=4,86795.10-2 K.W -1
Calcul de l'incertitude sur la résistance thermique (exprimée avec 1 seul chiffre significatif) :
U(RTh)=t95 .σn−1
√
n=2,20 x4,86795.10-2
√
12 =0,03 K.W -1
On doit adapter le nombre de chiffres significatifs de
̄
RTh
en fonction de l'incertitude
U(RTh)
.
Dans le cas présent, l'incertitude porte sur les centièmes, donc on arrondit
RTh=0,83 K.W -1
Présentation du résultat :
RTh=(0,83±0,03)K.W -1
L'expression précédente signifie qu'il y a 95% de chances que la valeur vraie de
RTh
soit incluse
dans l'intervalle [0,80 ; 0,86] appelé intervalle de confiance.
Note : Le coefficient de Student dépend du nombre de mesures et de l'intervalle de confiance fixé.
Si le nobre de mesures varie ou si l'on désire un autre intervalle il faut se référer au tableau ci-
dessous.

Nomenclature

Soupe aux Stroumphs
1)Spectroscopie visible
1.1)Soupe au Stroumpf
Doc 1
Recette de la soupe au Stroumpf selon Gargamel
•Prendre une belle marmite
•Faire bouillir de l'eau
•Introduire de la salsepareille
•Du sel, du poivre
•Autant de stroumpf que vous aurez réussi à capturer
•Faire mijoter le tout à feu doux pendant plusieurs
heures jusqu'à dissolution complète des Stroumphs.
•Déguster Chaud.
Doc 2
Les confiseurs utilisent des colorant alimentaires pour que la couleur de leurs confiseries reflète la
couleur de la matière première ou la couleur habituellement associée à un produit. Dans le cas
des stroumph le colorant est le bleu patenté.
L'union Européenne fixe, pour tous les colorants alimentaires, des valeurs de dose journalière
admissible. (DJA) Voici la DJA (en mg par Kg de masse corporelle et par jour) du bleu patenté
E131. DJA= 2,5mg/kg/Jour
Vous aussi préparez une soupe au Stroumpf ! Mais avec la contrainte de ne pas dépasser la DJA
de colorant...
Élaborez un protocole afin de pouvoir déguster cette soupe sans risque !
Pistes de réflexion :
•Piste n°1 : Une solution de bleu patenté à la concentration massique de 1,0.10-2 g.L-1 est
proposée au bureau.
•Piste n°2 : L'intensité de la coloration est fonction de la quantité de bleu patenté.
Résolution du problème :
•Préparer une solution se soupe au stroumph (avec une quantité de stroumph connue) et
comparer l'intensité de la coloration avec la solution de bleu patenté de référence.
•Introduire la solution de référence dans le spectrophotomètre afin de connaître la longueur
d'onde à laquelle cette solution absorbe le plus.
•Poursuivre l'étude de la solution de référence avec le spectrophotomètre afin de connaître le
coefficient de proportionnalité entre l'absorbance et la concentration massique de la solution.
(Loi de Beer-Lambert)
•Mesurer l'absorbance de la solution de soupe au stroumph et à l'aide de la loi de
Beer_Lambert en déterminer sa concentration massique.
Étape n°1 : Préparation de la soupe
•Arbitrairement on décide d'utiliser une fiole de 100,0mL dans laquelle on va introduire 5
stroumphs.
•On découpe en petits morceaux les stroumphs
•On place le tout sur un agitateur magnétique chauffant
Étape n°2 : Étude de la solution de référence.
•On introduit la solution de référence dans une cuve spectro après avoir fait le blanc avec la
solution de solvant (dans notre cas de l'eau)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
1
/
77
100%