TP de Physique 1 - Enseignement des Sciences Physiques

TP Terminale 25
1/2
SYNTHESE DU PARACETAMOL
Questions à propos de la réaction :
1.
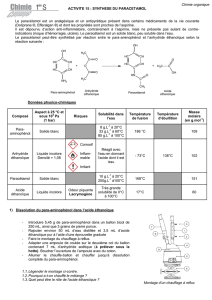
En rouge, sont entourés les groupes hydroxyles des fonctions alcool.
En vert, est entouré le groupe amine de la fonction amine.
En bleu, est entouré le groupe amide de la fonction amide.
2. Un atome H est remplacé par un groupe C(=O)-CH3 au niveau de la fonction amine. Il s’agit d’une
substitution.
3. L’azote possède un doublet non liant, il s’agit donc d’un site donneur d’électron.
4. L’anhydride éthanoïque aurait pu être attaqué par le groupe hydroxyle du para-aminophénol qui possède
aussi des doublets non liants.
5. a. Comme le groupe amine attaque préférentiellement l’anhydride, on peut supposer qu’il est plus
sujet à donner son doublet que le groupe hydroxyle.
b. La réaction est dite sélective car on obtient préférentiellement un produit parmi plusieurs possibles
selon le groupe donneur de doublet d’électrons.
6. a. D’après le tableau de données, l’anhydride réagit avec l’eau pour donner l’acide dont il est issu :
CH3C(O)OC(O)CH3 (aq) + H2O (l) → 2 CH3COOH (aq)
b. D’après les conditions opératoires, cette réaction est extrêment lente à température ambiante sinon
la réaction de synthèse du paracétamol n’aurait pas le temps de se faire. Par contre, si l’on chauffait le
milieu on favoriserait l’hydrolyse de l’anhydride empêchant alors la synthèse du paracétamol.
Rq : Ne pas chauffer, évite aussi d’emballer la réaction qui est déjà exothermique.
7.
HONH2
O
OO
HONH
O
CH3COOH
++
Paraaminophénol Anhydride éthanoïque Paracétamol
Acide éthanoïque
N
O
OO
+
H
HO
O
O
NHH
O
O
O
NH
H
O
O
O
NHH +
O
O
O
NHH +O
O
O
N
H
+H
Etape n°1
Etape n°2
Etape n°3
HO
OHOH
OH
OH
OH
Addition
Dissociation
Réaction
acide/base

TP Terminale 25
2/2
cristaux de
paracétamol
filtre
entonnoir
Büchner
fiole à vide
filtrat
Questions à propos du protocole :
1. L’acide éthanoïque favorise la dissolution du para-aminophénol dans l’eau. En effet, ce dernier est une
molécule organique donc peu soluble dans l’eau. Cependant, en présence de l’acide, un équilibre de
protonation de l’amine va s’établir ; la molécule devient chargée et donc plus soluble en milieu aqueux.
2. Chauffer permet en général d’augmenter la solubilité d’un corps. Cela accélère donc la dissolution du
para-aminophénol.
3. n(a-phénol) = m(a-phénol) / M(a-phénol) = 2,8 / 109 = 26.10-3 mol
n(an) = m(an / M(an) = (ρ(an).V(an)) / M(an) = (d(an).ρeau.V(an)) / M(an) = (1,08 × 1,0 × 3,5) / 102 = 37.10-3 mol
La réaction se fait mole à mole et « n(a-phénol) / 1 < n(an) / 1 »
donc le réactif limitant est le para-aminophénol.
4. m(paracétamol) = n(paracétamol) . M(paracétamol) = (1.xmax) . M(paracétamol) = 26.10-3 × 151 = 3,9 g
5. Pour les 20 mL d’eau et les 20 mL d’acide éthanoïque, les volumes n’étant précis qu’au millilitre,
on peut utiliser une éprouvette graduée.
Pour les 3,5 mL d’anhydride éthanoïque, il est préférable d’utiliser une pipette car la précision est
de l’ordre du dixième de millilitre.
6. L’étape n°1 correspond à la synthèse. L’étape n°2 constitue une filtration.
L’étape n°3 constitue une recristallisation. L’étape n°4 permet une identification du produit.
7. L’excès d’anhydride (preuve que l’autre réactif était bien en défaut …) est éliminé lors de l’étape n°2 par
ajout d’eau distillée. En effet, l’excès va alors réagir avec l’eau pour redonner l’acide éthanoïque (Cf 6.a)
qui lui est soluble dans l’eau et donc éliminé avec le filtrat.
L’excès est surtout éliminé lors de l’étape n°3 car le chauffage
favorisera l’hydrolyse de l’anhydride qui restera alors solubilisé dans
l’eau sous forme d’acide éthanoïque lors du refroidissement.
8. D’après le tableau des données, le paracétamol est moins soluble dans
l’eau froide que dans l’eau chaude (10 g à 20 °C et 250 g à 100 °C).
L’ajout d’eau glacée permet de diminuer la température du milieu et
donc de favoriser la précipitation du paracétamol sous forme de cristaux.
9.
10. Laver les cristaux après filtration permet d’éliminer les excès d’anhydride et d’acide éthanoïque
utilisés dans les étapes précédentes.
On utilise un minimum d’eau car le paracétamol n’est pas totalement insoluble dans l’eau donc plus
on lave les cristaux, plus on perd de produit !
On préfère de l’eau glacée pour les mêmes raisons que la question 8. Plus l’eau est froide, moins le
paracétamol est soluble dans l’eau et donc on perdra moins de produit lors du lavage.
11. a. L’intérêt de cette étape est de pouvoir séparer le produit sous forme de cristal et les impuretés.
b. Le but de la recristallisation est de purifier les cristaux obtenus, d’augmenter la pureté du produit.
Principe : Au cours d’une recristallisation, on choisit un solvant dans lequel les cristaux sont solubles
à chaud mais non à froid alors que les impuretés y sont solubles pour toute température.
Ainsi, on dissout les cristaux bruts dans le solvant en chauffant. Le produit et les impuretés sont
alors solubilisés. Puis, on refroidit la solution afin que les cristaux recristallisent lentement tandis que
les impuretés restent dans la phase liquide. Les cristaux sont ainsi purifiés.
12. La pureté du paracétamol aurait pu être déterminée par une CCM et vérifier la présence d’une seule
tache. Sinon, il faut essayer d’utiliser une caractéristique de la molécule précisée dans les données.
13. Sur le spectre IR du paracétamol, on note l’apparition de bandes fines et fortes entre 1600 et 1 700 cm-1
caractéristiques de la liaison C=O d’un amide.
Au-delà de 3 000 cm-1, on obtient des signaux assez larges plus ou moins intenses que l’on peut
difficilement interpréter du fait du recouvrement de plusieurs signaux correspondants notamment à la
liaison O-H de la fonction alcool présente dans les deux molécules et des liaisons N-H de l’amine.

TP Terminale 25
3/2
Néanmoins, le signal de la liaison O-H est plus net pour le paracétamol laissant supposé que la
fonction amine n’est plus libre comme précédemment (puisqu’elle se retrouve dans la fonction amide).
1
/
3
100%