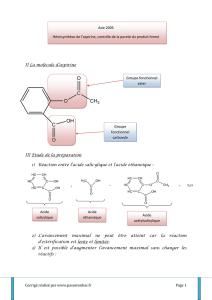
HEMISYNTHESE DE L`ASPIRINE Elle se fait à partir d`acide

HEMISYNTHESE DE L’ASPIRINE
Elle se fait à partir d’acide salicylique et d’acide éthanoïque ou d’anhydride éthanoïque, ce dernier
donnant de meilleurs rendements.
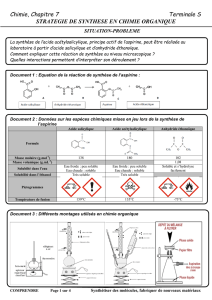
La réaction, en formule brute est la suivante :
C7H6O3(s) + C4H6O3(l) C9H8O4(s) + C2H4O 2(l)
En formules semi-développées, la réaction s’écrit :
+ +
Les formules semi-développées permettent de voir les fonctions chimiques des molécules.
1. Quelles sont les fonctions chimiques de chaque molécule ci-dessus ?
On donne :
La fonction alcool est caractérisée par le groupe par un groupe – OH (lié à un carbone)
La fonction acide carboxylique est caractérisée par le groupe - COOH
La fonction ester est caractérisée par le groupe - COOR avec R = chaîne carbonée
La fonction anhydride d’acide est caractérisée par le groupe - CO – O – CO -
Données :
Espèce
Etat
physique
Masse
volumique
Solubilité
Caractéristiques
Acide salicylique
Solide
Peu soluble dans l’eau à
froid.
Anhydride
éthanoïque
Liquide
1,05 g/mL
Très soluble dans l’eau
(réaction vive)
Aspirine
Solide
Peu soluble dans l’eau à
froid.
Acide éthanoïque
liquide
1,05 g/mL
Totalement soluble dans
l’eau.
On veut faire réagir nas = 0,04 mol d’acide salicylique et introduire l’anhydride éthanoïque en excès.
On prévoit d’utiliser Van = 10 mL.
1. Comment allez-vous prélever 0,04 mol d’acide salicylique ?
2. 10 mL d’anhydride éthanoïque sont-ils suffisants pour que cette espèce chimique soit en excès
par rapport à l’acide salicylique ?
3. Quelles précautions allez-vous prendre pour effectuer les deux prélèvements ?
C
O
OH
OH
C
O
OH
O
C
O
CH3
OH
O
C
H3C
CH3
C
O
O
C
O
CH3

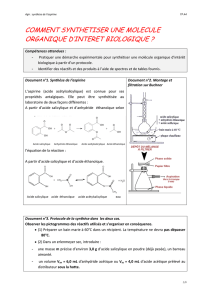
Pour que la réaction soit plus rapide, on chauffe le milieu réactionnel en utilisant un montage
spécifique, appelé « montage de chauffage à reflux » ; il est représenté ci-dessous :
Ballon
4. Quel est l’intérêt du réfrigérant ? Que
permet-il ?
5. Doit-on arrêter la circulation d’eau dès
que l’on arrête le chauffage ? Pourquoi ?
Un chauffage d’environ 10 minutes est
suffisant.
Après refroidissement, il faut extraire
l’aspirine du milieu réactionnel et pour cela,
on la fait précipiter, à froid, en ajoutant,
AVEC PRECAUTIONS, de l’eau glacée au
milieu réactionnel.
6. Que signifie « on la fait précipiter » ?
7. Pourquoi cette opération ne peut-elle se
réaliser qu’avec de l'eau glacée ?
8. Où va se trouver l’anhydride éthanoïque
en excès ? et l’acide éthanoïque formé ?
Justifier.
9. Si l’acide salicylique n’a pas totalement
réagi, où se trouve-t-il ?
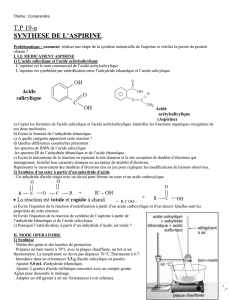
On filtre ensuite le milieu réactionnel avec le dispositif suivant appelé dispositif de filtration
Büchner :
10. Compléter la légende du schéma ci-dessus, en indiquant les espèces contenues dans le
filtrat et dans le gâteau (le solide).
11. Seule l’aspirine a des propriétés thérapeutiques ; il faut, comme toute molécule active
biologiquement, qu’elle soit pure. Comment pourrait-on vérifier expérimentalement la
pureté du solide obtenu ?
12. L’industriel qui fabrique l’aspirine cherche à avoir le meilleur rendement possible.
Comment fait-il pour déterminer le rendement de la réaction ?
A
rri
vé
e
d’
ea
u
Réfrigérant
Sortie
d’eau
Arrivée
d’eau
Chauffe-
ballon
Büchner
Fiole à vide
vers la trompe à vide
Filtrat
Gâteau
1
/
2
100%