Synthèse du paracétamol : Exercice de chimie TS

Physique-Chimie TS
Agir
Lycée Jacques Monod
Compétences :
S’approprier : extraire des informations
Réaliser : suivre un protocole, respecter les règles de sécurité, utiliser le matériel de
manière adaptée, organiser son poste de travail
Communiquer : rendre compte à l'écrit et conclure
Le paracétamol est un médicament utilisé pour ses propriétés analgésiques et antipyrétiques.
I- Sélectivité de la réaction
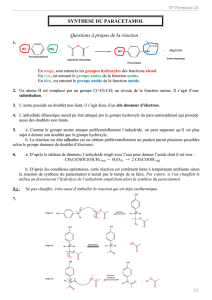
On donne les équations relatives aux synthèses de l'aspirine et du paracétamol.
1. Nommer les groupes caractéristiques présents dans les réactifs intervenant dans ces
synthèses. Identifier ceux qui réagissent. Quelles sont les fonctions crées ?
2. Lors de la réaction entre le 4-aminophénol (para-aminophénol) et l'anhydride éthanoïque
(anhydride acétique), le paracétamol se forme majoritairement, mais une autre espèce
chimique peut aussi se former minoritairement. En s'inspirant de la réaction de synthèse de
l'aspirine, donner la formule topologique de cette espèce.
3. On dit que le paracétamol est obtenu via une réaction sélective. A l'aide de cet exemple,
définir ce qu'est une réaction sélective.
SYNTHESE DU PARACETAMOL
En cas de douleurs, l'aspirine ou le paracétamol est prescrit,
pourtant il ne s'agit pas des mêmes molécules.
L'aspirine a, entre autres, un effet anticoagulant que n'a pas
le paracétamol.

Physique-Chimie TS
Agir
Lycée Jacques Monod
II- Synthèse
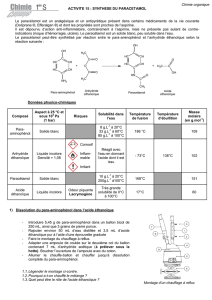
Observer les pictogrammes des réactifs utilisés et s'organiser en conséquence.
produit 4-aminophénol acide éthanoïque anhydride éthanoïque paracétamol
pictogrammes
températures
de
changement
d'état
T
fus
= 184 °C T
fus
= 16,6 °C
T
éb
= 118 °C
T
fus
= − 73,1 °C
T
éb
= 140 °C
T
fus
= 168 °C
solubilité
peu soluble dans l'eau
grande solubilité
dans l'eau et les
solvants
organiques
s'hydrolyse
facilement en acide
éthanoïque en
présence d'eau, très
soluble dans la
plupart des solvants
organiques
solubilité dans
l'eau :
10 g.L
−1
à 25 °C
250 g.L
−1
à 100 °C
masse molaire
109,2 g.mol
−1
60,1 g.mol
−1
102,9 g.mol
−1
151,2 g.mol
−1
1. Synthèse
• Dans l'erlenmeyer, introduire : 2,7 g de 4-aminophénol, 10 mL d'eau, 5 mL d'anhydride
éthanoïque, cet ajout s’effectue sous la hotte, avec précaution (gants et lunettes).
• Adapter le réfrigérant.
• Placer l'ensemble dans un bain-marie à 80°C et agiter. Laisser pendant 15 minutes,
le 4-aminophénol a été dissous et a réagi avec l’anhydride éthanoïque. Ensuite arrêter le
chauffage, baisser le support, tout en laissant la circulation d’eau, et ajouter par le haut
du réfrigérant 5 mL d’eau.
2. Cristallisation.
• En tenant l’erlenmeyer à l’aide de la pince, le refroidir d’abord dans l’air, puis sous l’eau
du robinet et enfin le placer dans un cristallisoir d’eau glacée. Attendre la cristallisation
(éventuellement ajouter quelques millilitres d’eau glacée).
• Filtrer sur entonnoir de Büchner (sous vide) et rincer à l'eau froide.
• Placer les cristaux dans un petit bécher.
spectre de RMN du proton du paracétamol

Physique-Chimie TS
Agir
Lycée Jacques Monod
3. Recristallisation.
• Dissoudre les cristaux dans 10 mL d'eau et chauffer lentement jusqu'à dissolution, (si la
dissolution n'est pas totale, rajouter de l'eau bouillante).
• Refroidir le bécher dans de l'eau, puis le placer dans un bain d'eau glacée.
• Filtrer les cristaux obtenus sur Büchner. Sécher les cristaux avec un papier filtre et
identifier- les sur banc Köfler.
4. Schématiser et légender le montage.
5. Quel est le rôle de l'agitation ?
6. Justifier les étapes de chauffage, puis de refroidissement du mélange.
7. Pourquoi a-t-on gardé la circulation d'eau alors que le chauffage est arrêté ?
8. Quel est l'avantage d'une filtration sur Büchner par rapport à une simple filtration ?
9. Lors de la recristallisation : pourquoi chauffe-t-on ? pourquoi laisse-t-on refroidir dans l'eau
avant de refroidir dans un bain de glace ?
10. Comment choisit-on le solvant de recristallisation ?
11. Quelle est la température de fusion du produit synthétisé ? La comparer à la valeur tabulée.
Conclure sur la pureté du produit obtenu.
12. Attribuer les signaux du spectre RMN à chaque groupe de protons équivalents.
1
/
3
100%