Synthèse du Paracétamol : Activité de Chimie Organique

Chimie organique
ACTIVITE 15 : SYNTHESE DU PARACETAMOL
Le paracétamol est un analgésique et un antipyrétique présent dans certains médicaments de la vie courante
(Doliprane ®, Efferalgan ®) et dont les propriétés sont proches de l’aspirine.
Il est dépourvu d’action anti-inflammatoire, contrairement à l’aspirine, mais ne présente pas autant de contre-
indications (risque d’hémorragie, ulcère). Le paracétamol est un solide blanc, peu soluble dans l’eau.
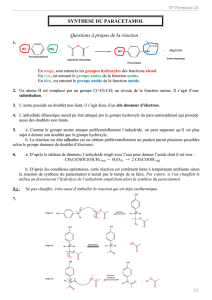
Le paracétamol peut-être synthétisé par réaction entre le para-aminophénol et l’anhydride éthanoïque selon la
réaction suivante :
Données physico-chimiques
Composé
Aspect à 25 °C et
sous 105 Pa
(1 bar)
Risques
Solubilité dans
l’eau
Température
de fusion
Température
d’ébullition
Masse
molaire
(en g.mol-1)
Para-
aminophénol
Solide blanc
8 g.L-1 à 20°C
33 g.L-1 à 60°C
85 g.L-1 à 100°C
186 °C
109
Anhydride
éthanoïque
Liquide incolore
Densité = 1,08
Corrosif
Réagit avec
l’eau en donnant
l’acide dont il est
issu
- 73°C
136°C
102
Inflam-
mable
Irritant
Paracétamol
Solide blanc
10 g.L-1 à 20°C
250g.L-1 à100°C
168°C
151
Acide
éthanoïque
Liquide incolore
Odeur piquante
Lacrymogène
Très grande
solubilité de 0°C
à 100°C
17°C
60
1) Dissolution du para-aminophénol dans l’acide éthanoïque
- Introduire 5,45 g de para-aminophénol dans un ballon bicol de
250 mL, ainsi que 3 grains de pierre ponce.
- Rajouter environ 50 mL d’eau distillée et 3,5 mL d’acide
éthanoïque pur à l’aide d’une éprouvette graduée
- Faire le montage du chauffage à reflux.
- Adapter une ampoule de coulée sur le deuxième col du ballon
contenant 7 mL d’anhydride acétique (à prélever sous la
hotte). Boucher l’ouverture de l’ampoule avec du coton.
- Allumer le chauffe-ballon et chauffer jusqu’à dissolution
complète du para-aminophénol.
1.1. Légender le montage ci-contre.
1.2. Pourquoi a-t-on chauffé le mélange ?
1.3. Quel peut être le rôle de l'acide éthanoïque ?
Montage d’un chauffage à reflux
HC
HC CCH
CH
C
OH
NH2
C O
O
H3C
C
H3C
O
+
HC
HC CCH
CH
C
OH
HN C
CH3
O
+H3C C
OH
O
Para-aminophénol Anhydride
éthanoïque Paracétamol Acide
éthanoïque

Chimie organique
ACTIVITE 15 : SYNTHESE DU PARACETAMOL
2) Synthèse du paracétamol par cristallisation
- Baisser le chauffe-ballon et refroidir le ballon dans une bassine
remplie d’eau froide puis ajouter goutte à goutte l’anhydride
acétique (attention, la réaction est exothermique !).
- Remettre le chauffe ballon en place et laisser chauffer à reflux
pendant environ 15 minutes.
- Pendant ce temps, refroidir environ 100 mL d’eau distillée.
- Refroidir le mélange dans un bain de glace : des cristaux blancs de
paracétamol apparaissent lentement par cristallisation. On peut
ensuite aider la cristallisation en "triturant" le fond du ballon avec un
agitateur en verre. Une fois les premiers cristaux apparus, la
cristallisation continue d’elle-même, ne plus « triturer ».
- Attendre quelques minutes que la précipitation du paracétamol soit
terminée.
- Filtrer le solide blanc sous vide sur un filtre Büchner et le rincer à
l’eau préalablement refroidie pour éliminer les impuretés.
- Sécher le paracétamol entre deux morceaux de papier filtre.
- Tarer le récipient qui contiendra le solide blanc et noter sa masse
puis peser le produit obtenu et noter aussi sa masse.
Filtration sous vide
sur filtre Büchner
La cristallisation d'un solide S dans un mélange est sa formation par diminution de sa solubilité dans le
mélange. La diminution de la solubilité du solide est due dans ce cas à une variation de température. L'existence
d'impuretés dans la solution favorise aussi la cristallisation.
2.1. Lors du chauffage à reflux, quel est le rôle des grains de pierre ponce ?
2.2. Quel est le rôle du réfrigérant ? Pourquoi doit-il rester ouvert à son extrémité ?
2.3. Légender la filtration sous vide sur filtre Büchner.
2.4. Quel est l'avantage de la filtration sous vide par rapport à une filtration simple ?
2.5. Pourquoi doit-on rincer les cristaux à l'eau glacée ? Quelle molécule organique retrouve-t-on dans le
filtrat ? Dans le filtre Büchner ? Expliquer votre raisonnement en utilisant les données physico-chimiques
des molécules concernées.
3) Rendement de la synthèse
3.1. Le réactif limitant est le para-aminophénol. À l’aide de l’équation de la réaction, déterminer la masse de
paracétamol que l’on doit théoriquement obtenir dans le cas d’une réaction totale.
3.2. Le rendement (êta en grec) d’une synthèse correspond au rapport de la masse réellement obtenue
par la masse théorique. Déterminer le rendement de la synthèse du paracétamol, sachant que l'on
obtient 6,05 g de paracétamol.
3.3. À votre avis, pourquoi le rendement de cette réaction n’est pas de 100 % ?

Chimie organique
ACTIVITE 15 : SYNTHESE DU PARACETAMOL
CORRECTION
Dissolution du para-aminophénol dans l’acide éthanoïque
1.1 Légender le montage ci-contre.
1 réfrigérant à boules ; 2 entrée d'eau ; 3 sortie d'eau ; 4 ballon bicol ; 5 chauffe ballon ; 6 élévateur ; 7 ampoule
de coulée ; 8 para-aminophénol + eau distillée + acide éthanoïque + pierre ponce ; 9 anhydride acétique.
1.2 Pourquoi a-t-on chauffé le mélange
Pour accélérer la réaction.
1.3 Quel peut être le rôle de l'acide éthanoïque ?
Il sert à dissoudre le para-aminophénol. Les réactions étant plus faciles entre liquides.
Synthèse du paracétamol par cristallisation
2.1. Lors du chauffage à reflux, quel est le rôle des grains de pierre ponce ?
Réguler l'ébulition.
2.2. Quel est le rôle du réfrigérant ?
Il sert à empêcher les vapeurs de quitter le milieu réactionnel. En effet, celles-ci se condensent au
contact du réfrigérant et retombent, liquides, dans le milieu réactionnel.
Pourquoi doit-il rester ouvert à son extrémité ?
Pour que la pression n'augmente pas.
2.3. Légender la filtration sous vide sur filtre Büchner.
10 entonnoir büchner et filtre ; 11 sortie de l'air aspiré ; 12 fiole à vide ; 13 filtrat ; 14 agitateur en verre.
2.4. Quel est l'avantage de la filtration sous vide par rapport à une filtration simple ?
Le vide aspire mieux que la gravitation.
2.5. Pourquoi doit-on rincer les cristaux à l'eau glacée ?
Dans l'eau chaude, le paracétamol se dissout.
Quelle molécule organique retrouve-t-on dans le filtrat ?
L'acide éthanoïque.
Dans le filtre Büchner ?
Le paracétamol.
Rendement de la synthèse
3.1 Le réactif limitant est le para-aminophénol. À l’aide de l’équation de la réaction, déterminer la masse de
paracétamol que l’on doit théoriquement obtenir dans le cas d’une réaction totale.
donc
3.2 Le rendement (êta en grec) d’une synthèse correspond au rapport de la masse réellement obtenue
par la masse théorique. Déterminer le rendement de la synthèse du paracétamol.
3.3 À votre avis, pourquoi le rendement de cette réaction n’est pas de 100 % ?
Car la réaction inverse a lieu.
1
/
3
100%