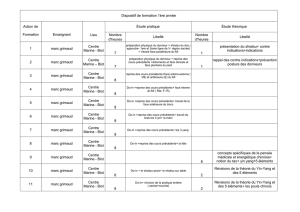
Rôle de l`ARC

V Grimaud - UE recherche clinique -
18 mars 2011 1
Rôle de l
Rôle de l’
’ARC
ARC
V Grimaud - UE recherche clinique -
18 mars 2011 2
D
Dé
éfinitions
finitions
zARC : Assistant de Recherche Clinique
zTEC : Technicien d’Étude Clinique
zPromoteur : Personne physique ou morale qui
prend l’initiative de la recherche
zInvestigateur principal : personne physique qui
dirige et surveille la réalisation de la recherche.
zARC # délégué médical

V Grimaud - UE recherche clinique -
18 mars 2011 3
Présentation
Ma formation :
Bac + 5 en sciences (chimie-biologie)
Une formation en recherche clinique (Sup’santé)
3 mois de cours théorique
6 mois de stage (CIC Grenoble)
Ma fonction :
ARC au CIC de Grenoble
Unité du Pr JL BOSSON
Etudes : publiques et industrielles en médecine vasculaire
V Grimaud - UE recherche clinique -
18 mars 2011 4
Les études en cours ou à venir
CIC = centre investigateur
Etudes sur la MTEV
-industrielles
-financées par un PHRC
CIC = centre de coordination
En cours
- Étude observationnelle sur les traumatismes des membres inférieurs
en station de sports d’hiver
- Étude en recherche biomédicale en urgence sur la prise en charge de
l’arrêt cardiaque
En préparation
-Etude en recherche biomédicale sur la contention veineuse
-Etude en recherche biomédicale sur le stage thermal post thrombose
Arrêt prématuré
- Étude internationale en soins courants sur les D-Dimères

V Grimaud - UE recherche clinique -
18 mars 2011 5
Rôle de l’ARC - centre de
coordination
- rédaction du protocole (aspects pratiques et
réglementaires)
- élaboration de documents de l’étude
- choix d’un logo et d’un acronyme
- étapes réglementaires (CPP, CNIL…)
- recrutement et soutien aux investigateurs
- sélection des patients
V Grimaud - UE recherche clinique -
18 mars 2011 6
les
les é
étapes r
tapes ré
églementaires
glementaires

V Grimaud - UE recherche clinique -
18 mars 2011 7
Les étapes réglementaires
-Inscription sur clinicaltrials.gov
Promoteur
CPP
CCTIRS /CNIL
Avis favorable
Accord
Début de
l’essai
AFSSAPS Autorisation
1
1bis
2
Sous 60 jours
1 + 2 Mois
V Grimaud - UE recherche clinique -
18 mars 2011 8
les documents de l
les documents de l’é
’étude
tude

V Grimaud - UE recherche clinique -
18 mars 2011 9
Les documents de l’étude
-Élaboration du cahier d’observation électronique (3 semaines)
1- modèle papier : on met en forme l’ensemble des variables à
recueillir, les contrôles souhaités
2- ce modèle papier est transmis à la société Clininfo qui crée le
cahier d’observation électronique
3- test du cahier
- Élaboration des documents nécessaires aux investigateurs : la
plaquette de l’étude, les fax d’inclusion, les fiches aide-mémoire…
V Grimaud - UE recherche clinique -
18 mars 2011 10
Les investigateurs :
recrutement et soutien
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
1
/
22
100%