La réaction d`oxydoréduction

La réaction d'oxydoréduction
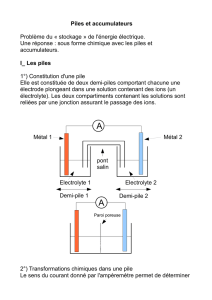
1)Comment définir un oxydant ou un réducteur ?
1.1)Expèrience préliminaire
On introduit dans un tube à essais de la paille de fer. Puis on verse dans le tube une solution de
sulfate de cuivre. (support+1tube à essais bouché avec CuSO4 et un tube à essai avec de la paille
de fer)
Faire un schéma de la manipulation :
Instant initial Etat final
1)Quelles sont vos observations ?
On remarque que la paille de fer s'est recouverte de cuivre.
2)Quelles sont les espèces chimiques présentes au début de la manipulation ?
Fe(s), Cu2+(aq) SO42-(aq)
3)Quelles sont les espèces chimiques présentes à la fin de la réaction ?
On voit apparaître du cuivre à l'état solide. En ce qui concerne le fer, il en reste toujours. Pour les
ions sulfate, il est impossible à l'oeil nu sans autre expèrience de savoir.
4)Qu'est-il nécessaire de fournir aux ions Cu2+(aq) pour qu'ils puissent repasser à l'état solide ?
Les ions Cu2+(aq) ont besoin de deux électrons.
5)Etablir l'équation de la réaction qui a permis au cuivre de devenir solide.
Cu2+(aq) + 2e- = Cu(s)
1.2)Définitions
Lors de la réaction précédente, il y a eu un transfert d'électrons. Ce transfert a eu lieu entre les
ions Cu2+(aq) et Fe(s). Ce transfert d'électrons entre est une réaction d'oxydoréduction.
• Une réaction d'oxydo-réduction est une réaction qui met en jeu un transfert d'électrons entre
ses réactifs
• Un oxydant est une espèce chimique susceptible de capter au moins un électron.
• Un réducteur est une espèce chimique susceptible de céder au moins un électron.
• Une réaction d'oxydoréduction ne peut se produire qu'entre un oxydant et un réducteur.
Exercice :
Parmis les réactions suivantes, entourez en rouge les oxydants et en bleu les réducteurs.
•Cuivre et nitrate d’argent : Cu(s) + Ag+(aq) = Cu2+(aq) + Ag(s)
•Zinc et sel de Mohr : Fe2+(aq) + Zn(s) = Fe(s) + Zn2+(aq)
•Cuivre et sulfate de zinc : Cu(s) + Zn2+(aq) = Cu2+(aq) + Zn(s)

1.3)Couple oxydant/réducteur
Les ions Cu2+(aq) sont capables de capter deux électrons. Ce sont des oxydants. Lors de cette
transformation il se forme du cuivre à l'état solide Cu(S). Le cuivre à l'état solide est capable de
céder deux éléctrons (réaction inverse). Dans ce cas il est un réducteur.
De manière générale, tout oxydant est associé à un réducteur. Pour le cuivre l'équation de la
transformation est :
Cu2+(aq) + 2e- = Cu(s)
Oxydant + ne- = Réducteur
Définitions :
•On appelle couple oxydant/réducteur, deux entités chimiques qui se transforment l’une en
l’autre par transfert d’électrons. On représente ce transfert par la demi-équation :
Oxydant + n é = réducteur
•Le couple oxydant/réducteur dans le cas du cuivre se note : Cu2+(aq)/Cu(s)
1.4)Les oxydants et les réducteurs dans la classification périodique
•Les réducteurs sont généralement des métaux. I se situent au milieu de la classification
périodique.Les réducteurs les plus puissants sont les plus à gauche; les alcalins comme le
sodium ou les alcalino-terreux comme le calcium sont de puissants réducteurs).
•Les oxydants se situent sur la droite de la classification périodique.Les halogènes (F2; I2; Cl2;
O2) sont de puissants oxydants.
1.5)Etablir la demi-équation d'un couple
On étudie dans cet exemple le couple MnO4_(aq)/Mn2+(aq) (ion permanganate/ion manganèse):
Etape n°1 : A partir de la définition précédente on peut écrire pour un couple Ox/Red la relation
suivante :
Oxydant + n é = réducteur
MnO4_(aq)+ ne- = Mn2+(aq)
Etape n°2 : Conservation des éléments chimiques.
•Conservation du manganèse :
MnO4_(aq)+ ne- = Mn2+(aq)
• Conservation de l'oxygène à l’aide des molécules qui constituent le solvant (ici l’eau)
MnO4_(aq)+ ne- = Mn2+(aq) + 4H2O(l)
• Conservation de l’élément hydrogène à l’aide des ions hydrogène hydratés
MnO4_(aq)+ ne- + 8H+(aq) = Mn2+(aq) + 4H2O(l)
Etape n°3 : Conservation de la charge à l'aide des électrons.
MnO4_(aq)+ 5ne- + 8H+(aq) = Mn2+(aq) + 4H2O(l)

Exercice d'entraînement :
Etablr la demi-équation du couple : HclO(aq)/Cl2(aq)
Etape n°1 : A partir de la définition précédente on peut écrire pour un couple Ox/Red la relation
suivante :
Oxydant + n é = réducteur
HClO(aq)+ ne- = Cl2(g)
Etape n°2 : Conservation des éléments chimiques.
•Conservation du manganèse :
2HClO(aq)+ ne- = Cl2(g)
• Conservation de l'oxygène à l’aide des molécules qui constituent le solvant (ici l’eau)
2HClO(aq)+ ne- = Cl2(g) + 2H2O(l)
• Conservation de l’élément hydrogène à l’aide des ions hydrogène hydratés
2HClO(aq)+ ne- + 2H+(aq) = Cl2(g) + 2H2O(l)
Etape n°3 : Conservation de la charge à l'aide des électrons.
2HClO(aq)+ 2e-+ 2H+(aq) = Cl2(g) + 2H2O(l)
2)La réaction d'oxydo-réduction
2.1)Etude de la réaction entre le diiode et le thiosulfate de sodium
Soit le couple I2/I- , (diiode/ion iodure) établir la demi-équation de ce couple :
I2(aq)+2e-= 2I-(aq)
Soit le couple S4O62-/S2O32-, (ion tétrathionate/ion thiosulfate) établir la demi-équation de ce couple :
S4O62-(aq)+2e-= 2S2O32-(aq)
On désire faire réagir le diiode avec les ions thiosulfate. Cette réction est-elle possible ?
Pourquoi ?
Cette réaction est possible car le diiode est un oxydant (il peut capter des électrons) et que l'ion
thiosulfate est un réducteur qui peut céder des électrons. Dans ce cas précis le thiosulfate peut
céder deux électrons et le diiode peut en accepter deux.
Définition :
Une réaction d’oxydoréduction est le siège d’un échange d’électrons entre le réducteur d’un
couple d’oxydoréduction qui cède des électrons et l’oxydant d’un autre couple redox qui les
accepte.
Exemple n°1 :Les coulpes mis en jeu lors de cette réaction sont :
MnO4_(aq)/Mn2+(aq)
Fe3+(aq)/Fe2+(aq)
Ecrire l'équation de la réaction entre le permenganate et l'ion fer II :
MnO4_(aq)/Mn2+(aq) MnO4_(aq)+ 5é + 8H+(aq) = Mn2+(aq) + 4H2O(l)
Fe3+(aq)/Fe2+(aq) Fe2+(aq) = Fe3+(aq) + é (x5)
MnO4_(aq)+ 5 Fe2+(aq) + 8H+(aq) = Mn2+(aq) +5 Fe3+(aq) + 4H2O(l)
Exemple n°2 : Les coulpes mis en jeu lors de cette réaction sont :
I2/I-
S4O62-/S2O32-

Ecrire l'équation de la réaction entre le diiode et l'ion thiosulfate:
I2(aq) / I-(aq) I2(aq) + 2e- = 2I-(aq)
S4O62-(aq) / S2O32-(aq) 2 S2O32-(aq) + 2e- = S4O62-(aq)
I2(aq) + 2 S2O32-(aq) = 2I-(aq) + S4O62-(aq)
2.2)De manière générale :
Soient deux couple Ox1/Red1 et Ox2/Red2 l'équation de la réaction traduit l'échange d'électrons de
entre le réducteur d'un couple et l'oxydant couple.
L'équation de la réaction peut alors s'écrire :
Ox1/Red1 Ox1+ n1e- = Red1 (x n2) Réduction
Ox2/Red2 Red2 =Ox2 + n2e- (x n1) Oxydation
n2Ox1 + n1Red2 = n2 Red1 + n1Ox2
2.3)Réaction de titrage
Exercice :
Soient deux solutions :
•Une solution S1 de diiode de concentration C1 et de volume V1
•Une solution S2 de thiosulfate de sodium de concentration C2 et de volume ajouté à la
burette Va
Rappeler l'équation de la réaction d'oxydoréduction entre ces deux espèces chimiques :
I2(aq) + 2 S2O32-(aq) = 2I-(aq) + S4O62-(aq)
Compléter le tableau d'avancement suivant :
Équation chimique I2(aq) +2S2O32-(aq) =2I-(aq) +S4O62-(aq)
Etat du
système
Avancement
(en mol)
Quantités de matières (en mol )
État initial X=0 ni,I2(aq)=C1.V1n i,S2O32-(aq)=C2.Va0 0
A l'équivalence Xequivalence
C1.V1 - Xeq= 0 C2.Va - 2Xeq= 0 n e,I-(aq)= 2Xeq n e,S4O62-(aq)= Xeq
Déterminer la relation qui lie C1 ,V1 , C2 , et Va à l'équivalence :
Le système à l'équivalence est :
C1.V1 - Xeq= 0 Xeq= C1.V1
C2.Va - 2Xeq= 0 Xeq=
C2.Va
2
Donc :
C2.Va
2
= C1.V1
En général :
On considère des couples ox/red : Ox1/Red1 et Ox2/Red2
L'équation de la réaction peut alors s'écrire :

Ox1/Red1 Ox1+ n1e- = Red1 (x n2) Réduction
Ox2/Red2 Red2 =Ox2 + n2e- (x n1) Oxydation
n2Ox1 + n1Red2 = n2 Red1 + n1Ox2
Soient deux solutions :
•Une solution S1 d'oxydant 1 de concentration C1 et de volume V1
•Une solution S2 de réducteur 2 C2 et de volume ajouté à la burette V2
Compléter le tableau d'avancement de cette réaction est :
Équation chimique n2Ox1 +n1Red2=n2 Red1+Ox2
Etat du
système
Avancement
(en mol)
Quantités de matières (en mol )
État initial X=0 ni,Ox1=C1.V1n i,Red2(aq)=C2.V20 0
A l'équivalence Xequivalence
C1.V1 - n2Xeq= 0 C2.V2 - n1Xeq= 0 n e,I-(aq)=n2Xeq n e,S4O62-(aq)=
n1Xeq
Détermination de la relation qui lie C1 ,V1 , C2 , et V2 à l'équivalence :
Le système à l'équivalence est :
C1.V1 - n2Xeq= 0 Xeq=
C1.V1
n2
C2.V2 - n1Xeq= 0 Xeq=
C2.V2
n1
Donc :
C1.V1
n2
=
C2.V2
n1
1
/
5
100%