Chapitre X : Oxydoréduction et pile Programme officiel

Chapitre X : Oxydoréduction et pile
Programme officiel :
Compétences du programme
Activité ou TP
Pratiquer une démarche expérimentale pour réaliser une pile et modéliser son
fonctionnement. Relier la polarité de la pile aux réactions mises en jeu aux électrodes.
Reconnaître l’oxydant et le réducteur dans un couple.
Écrire l’équation d’une réaction d’oxydo-réduction en utilisant les demi-équations redox.
Act 13
TP 16
------------------------------------------------------------------------------ Ce qu'il faut savoir :
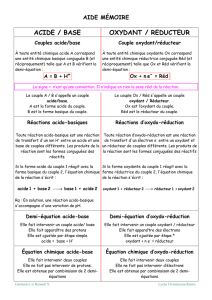
Oxydant : Espèce chimique capable de gagner un ou plusieurs électrons.
Réducteur : Espèce chimique capable de céder un ou plusieurs électrons.
Couple Redox : Toujours dans l'ordre Oxydant / Réducteur
½ équation associée à un couple : Ox + n e- Red
Réaction d'oxydo-réduction : Réaction entre 2 couples Oxydant / Réducteur ; l'oxydant d'un couple
réagissant avec le réducteur de l'autre couple.
Schéma de la pile.
Il n'y a jamais d'électrons dans une solution.
------------------------------------------------------------------------------ Ce qu'il faut savoir faire :
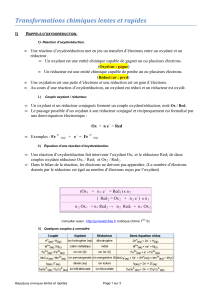
- Ecrire la 1/2 équation simple (ou écriture formelle) d'un couple
- Ecrire la 1/2 équation complexe (avec ajout de protons H+ et ou d'eau) d'un couple
- Ecrire l'équation de la réaction entre deux couples
Pièges et astuces :
- Il ne peut pas rester d'électrons libres dans le milieu réactionnel. Il ne doit donc pas y avoir
d'électrons dans l'équation bilan de la réaction entre deux couples.
- Dans une 1/2 équation, il peut être nécessaire de rajouter des protons H+ et ou de l'eau pour
pouvoir équilibrer la 1/2 équation.
- Dans le cas d'un ajout de protons, la réaction réelle a lieu en milieu acide.
- Dans un énoncé, bien repérer qui est l'oxydant du premier couple réagissant avec le réducteur du
deuxième couple.
1
/
1
100%