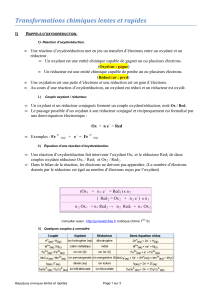
1)- Réaction d`oxydoréduction.

Réactions chimiques lentes et rapides Page 1 sur 3
Transformations chimiques lentes et rapides
I) RAPPELS D’OXYDOREDUCTION.
1)- Réaction d’oxydoréduction.
Une réaction d’oxydoréduction met en jeu un transfert d’électrons entre un oxydant et un
réducteur.
Un oxydant est une entité chimique capable de gagner un ou plusieurs électrons.
(Oxydant : gagne)
Un réducteur est une entité chimique capable de perdre un ou plusieurs électrons.
(Réducteur : perd)
Une oxydation est une perte d’électrons et une réduction est un gain d’électrons.
Au cours d’une réaction d’oxydoréduction, un oxydant est réduit et un réducteur est oxydé.
1) Couple oxydant / réducteur.
Un oxydant et un réducteur conjugués forment un couple oxydant/réducteur, noté Ox / Red.
Le passage possible d’un oxydant à son réducteur conjugué et réciproquement est formalisé par
une demi-équation électronique :
Ox + n e - = Red
Exemples : Fe 3+ (aq) + e - = Fe 2+ (aq)
2) Équation d’une réaction d’oxydoréduction.
Une réaction d’oxydoréduction fait intervenir l’oxydant Ox1 et le réducteur Red2 de deux
couples oxydant réducteur Ox1 / Red1 et Ox2 / Red2.
Dans le bilan de la réaction, les électrons ne doivent pas apparaître. (Le nombre d’électrons
donnés par le réducteur est égal au nombre d’électrons reçus par l’oxydant)
(Ox 1 + n 1 e - = Red 1) x n 2
( Red 2 = Ox 2 + n 2 e -) x n 1
n 2 Ox 1 + n 1 Red 2 n 2 Red 1 + n 1 Ox 2
Consulter aussi : http://jj.mevel2.free.fr (rubrique chimie 1ère S)
3) Quelques couples à connaître

Réactions chimiques lentes et rapides Page 2 sur 3
II) LA CINETIQUE CHIMIQUE
1) Définition
2) Classification des réactions chimiques
a) Transformation rapide
b) Transformation lente
III) TRANSFORMATION RAPIDES
1) Réactions acido-basique
On mélange une solution aqueuse d’hydroxyde de sodium et une solution d’acide chlorhydrique.
C’est une réaction rapide .Les réactifs et les produits sont incolores : on ne peut pas suivre visuellement la réaction chimique.
1. Ecrire l’équation de la réaction chimique
Rappel : 1) réactifs 2) couples 3) demi équations 4) équation.
2. Comment pourrait- on suivre la transformation chimique au cours du temps ?
2) Réactions de précipitations
Ce sont des réactions rapides entre un cation et un anion.
Exemple : on mélange une solution de nitrate d’argent et une solution de chlorure de sodium : il apparaît instantanément un
précipité blanc de chlorure d’argent (AgCl(s))
Ecrire l’équation de la réaction de précipitation
3) Réaction rédox
On mélange une solution de thiosulfate de sodium incolore et une solution jaune de diiode..La solution devient immédiatement
incolore.
Ecrire l’équation de la réaction rédox.(voir le rappel ci-dessus)
IV) TRANSFORMATION LENTES
1) Oxydation du métal fer à l’air ambiant.
2) Réaction rédox
On mélange une solution d’iodure de potassium (incolore) et de l’eau oxygénée (incolore de formule H2O2(aq) )
On observe l’apparition lente d’une couleur jaune, qui devient progressivement plus intense et qui évolue vers le brun.
1) Quelle est l’espèce chimique responsable de la couleur qui apparaît ?
2) Ecrire l’équation de la réaction chimique (voir le rappel)
Donnée : couple H2O2(aq) / H2O(l)
V) FACTEURS CINETIQUES
1) Définition
2) Concentration des réactifs
3) Température
VI) APPLICATION
Certaines transformations chimiques sont trop lentes. On augmente la vitesse de la transformation à l'aide des facteurs
cinétiques.
Dans d'autres cas, l'augmentation de la température permet d'initier des réactions qui ne se font pas à température ambiante.

Réactions chimiques lentes et rapides Page 3 sur 3
1) Accélérer une réaction chimique ou l’amorcer
Quelques exemples :
Combustion de l'essence
Dans un moteur à explosion, la transformation chimique est amorcée par une étincelle crée par la bougie à la fin de la
compression. Le mélange (gaz + air) ne réagit pas à température ambiante. C'est l'élévation brusque de la température par
l'étincelle qui provoque la combustion.
Cuisson des aliments
Le temps de cuisson des aliments dépend de la température à laquelle ils sont portés.
L’autocuiseur (type cocotte-minute) permet d'accélérer la cuisson des aliments. Dans celui-ci, en effet, sous l'effet de la
pression, l'eau se trouve à une température de l'ordre de 110 °C.
2) Ralentir une réaction chimique ou la bloquer
Quelques exemples
Applications industrielles
Certaines transformations sont trop rapides et peuvent s'emballer. Pour éviter les risques industriels liés à des réactions qui
libèreraient trop d'énergie, on contrôle la température des milieux réactionnels.
Ce contrôle peut être effectué en diminuant la température ou en diluant les réactifs (la concentration diminue). La vitesse
de la transformation diminue et la transformation est plus lente.
Conservation des aliments
A température ambiante, les composés chimiques contenus dans les aliments s'altèrent et se dégradent. On observe diverses
transformations chimiques (oxydation des vitamines, apparition de composés dérivés toxiques, etc.). Afin d'éviter ces
transformations, on conserve les aliments à basse température. La vitesse de la transformation est alors si lente qu'il faut
plusieurs jours avant que les produits apparaissent.
Dans certains cas, pour éviter la prolifération des bactéries, on congèle les produits ; ceux-ci peuvent alors se conserver
plusieurs mois sans altération.
Bloquer une réaction chimique
La tempe consiste à refroidir brutalement (avec de la glace par exemple) le mélange réactionnel à un instant t . La réaction
chimique est alors bloquée . On peut analyser le milieu réactionnel à la date t du refroidissement.
Dans certains cas on verse de l’eau glacée dans le mélange réactionnel : on réalise simultanément une trempe et la dilution des
réactifs. La réaction chimique est alors bloquée.
1
/
3
100%