Exercices sur les réactions d`oxydo

Exercices sur les réactions d'oxydo-réduction.
Utilisez le classement en bas de page lorsque c’est nécessaire
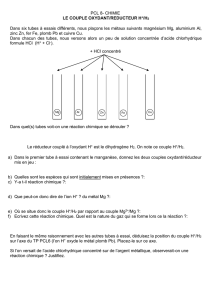
1) On plonge une pièce en cuivre ( Cu) dans une solution de sulfate de zinc ( Zn2+ ; SO42- ).
La pièce en cuivre se recouvre d'une pellicule métallique.
a) Que c'est-il passé ?
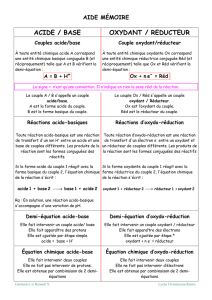
b) Ecrire les deux demi-équations ainsi que l'équation bilan de cette réaction.
Vous préciserez quelle est la réaction d'oxydation et quelle est la réaction de réduction.
c) Qui était l'oxydant et qui était le réducteur de cette réaction?
d) Quelle sera la couleur de la réaction à la fin de l'expérience?
2) Les réactions suivantes ont-elles lieu?
Si oui, écrivez les deux demi-équations, puis l'équation bilan de la réaction.
a)
Li Zn Li Zn
2
.
b)
Pb Fe Pb Fe
2 2
.
c)
Ag Al Ag Al
3
.
d)
Au Cu Au Cu
3 2
.
3) A partir des réactions qui suivent classez les couples oxydant-réducteur:
Sn2
/ Sn ;
K
/ K ;
Au3
/ Au ;
Pt2
/ Pt ; du moins oxydant au plus oxydant.
Sn KSn K
22 2
2 3 2 3
3 2
Au Pt Au Pt
Pt Sn Pt Sn
2 2
.
4) On veut conserver une solution de chlorure d'argent ( Cl- ; Ag+ ).
a) Peut on la conserver dans un récipient en fer ( Fe ) ?
Expliquer pourquoi.
b) Peut-on conserver la solution dans un récipient en or ( Au ) ?
Expliquez pourquoi.
c) Donnez un autre métal dans laquelle on pourrait conserver le chlorure d'argent.
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
De plus en plus
réducteur De plus en plus
oxydant
L i+/Li Al3+/Al Zn2+/Zn Fe2+/Fe Pb2+/Pb Cu2+/Cu Ag+/Ag Hg2+/Hg Au3+/Au Ce3+/Ce
1
/
1
100%