2017-TP titrage aspirine 500

1
Démarche expérimentale
Contrôle qualité d’un comprimé d’aspirine 500
Objectif : déterminer la masse d’acide acétylsalicylique contenue dans un comprimé d’aspirine 500 à l’aide
d’une méthode expérimentale.
Actions étudiants
Compétences développées
Matériel proposé :
un comprimé d’aspirine 500
éthanol
solution aqueuse d’hydroxyde de sodium à
pipettes jaugées de 10,0 ; 20,0 ; 25,0 mL
éprouvette graduée de 50 mL
burette graduée de 25,0 mL
erlenmeyer
béchers
fiole jaugée de 100,0 mL et bouchon
indicateurs colorés acido-basiques
mortier + pilon
entonnoir
pH-mètre + électrodes + solutions tampons (4 ; 7)
conductimètre + cellule
Proposer un protocole pour répondre à l’objectif.
Mettre en œuvre ce protocole après discussion avec le
professeur.
Rédiger un compte rendu de vos activités.
Annexe 1 : étiquette de la boîte de comprimés proposée
ANA
L
CMQ
VAL
REA
A
CMQ
S’APPROP

2
Annexe 2 : l’acide acétylsalicylique
Introduction et historique
L'aspirine est l'un des médicaments les plus connus, les plus courants et les plus populaires. A l'échelle
mondiale, cela représente plus de 35 000 tonnes ou 100 milliards de comprimés ! Pourtant, on dit souvent
que si elle était découverte de nos jours, elle n'obtiendrait pas l'autorisation de mise sur le marché nécessaire
à un médicament pour être commercialisé, eu égard à ses effets secondaires.
Aspirine vient du nom commercial qui désignait le premier médicament dont le principe actif était l'acide
acétylsalicylique (Aspirin, médicament mis sur le marché en 1899). Le nom chimique de cette molécule est
l'acide 2-(acétyloxy)benzoïque. Cette molécule est présente à l'état naturel dans un certain nombre de plantes
comme le saule (Salix alba, qui est à l'origine du nom acide acétylsalicylique) ou la reine-des-prés (Filipendula
ulmaria mais anciennement dénommée Spiraea ulmaria, ce qui est à l'origine du nom aspirine). De ce fait, on
utilise l'aspirine depuis très longtemps : des décoctions de feuilles de saule étaient utilisées durant l'antiquité
par les grecs (400 avant J.C.) pour lutter, déjà, contre la douleur et la fièvre.
Synthèse
De nos jours, l'aspirine utilisée en pharmacopée n'est plus extraite d'une plante mais obtenue par synthèse
chimique à partir de phénol (C6H5OH). La dernière étape de sa synthèse, l'acétylation de l'acide salicylique, est
une réaction relativement simple couramment réalisée en travaux pratiques de chimie.
1. Les effets de l'aspirine
Les effets bénéfiques
L'aspirine est un médicament en vente libre donc largement utilisé en automédication. Il est couramment
utilisé en cas de douleur (action antalgique) et en cas de fièvre (action antipyrétique), même si de nos jours on
lui préfère souvent le paracétamol ou l'ibuprofène qui présentent moins d'effets secondaires.
Par ailleurs, l'aspirine est très utilisée pour son action anticoagulante, par exemple en prévention de
problèmes circulatoires lors de l'immobilisation d'un membre par un plâtre. L'utilisation préventive de
l'aspirine est d'ailleurs un domaine dans lequel ce médicament regagne les points qu'il a perdu dans la lutte
contre la douleur et la fièvre. On vient de citer la prévention du risque vasculaire en cas d'entorse par
exemple, mais les indications sont bien plus larges. En traitement préventif à faible dose, il a été démontré, ou
il est suspecté, que l'aspirine est efficace pour prévenir de nombreuses pathologies telles que les infarctus, les
accidents vasculaires cérébraux, certains problèmes liés à la grossesse, mais aussi le cancer et peut-être la
maladie d'Alzheimer. Il semble cependant que les effets préventifs bénéfiques se manifestent surtout chez les
personnes présentant un risque particulier (antécédents, diabète, etc...). Ce qui est fascinant avec ce
médicament, c'est qu'après tant d'années on découvre encore de nouveaux services rendus et qu'il reste
visiblement encore beaucoup de choses à découvrir à son sujet.
Les effets indésirables
Le principal problème de l'aspirine c'est qu'elle n'est pas dépourvue d'effets secondaires.
Pour commencer, l'aspirine a des effets indésirables pour les cellules de l'oesophage, de l'estomac et
du duodénum, elle peut entrainer des lésions du système gastro-intestinal : hémorragies digestives,
ulcères gastriques voire perforation de la paroi.

3
L'aspirine peut également entrainer des problèmes hématologiques. En effet ses propriétés
anticoagulantes, bénéfiques dans certaines situations, peuvent devenir dangereuses dans d'autres
situations puisqu'une hémorragie aura plus de mal à s'arrêter.
Un autre effet secondaire, éventuellement sévère, est le risque allergique. Différentes manifestations
allergiques peuvent survenir comportant des réactions cutanées comme de l'urticaire, mais aussi des
réactions beaucoup plus dangereuses, voire mortelles, comme de l'asthme, des réactions
anaphylactique (violente réaction allergique pouvant entraver la circulation sanguine), un oedème de
Quincke (forme particulière d'urticaire caractérisé par un gonflement sous-cutané du visage et du cou,
et surtout des muqueuses buccales et ORL pouvant réduire le diamètre des voies aériennes
supérieures, voire les obstruer), ou un syndrome de Reye (maladie aigüe très grave caractérisée par
des atteintes cérébrale et hépatique. Très rare, de cause inconnue, ce syndrome survient
généralement chez des enfants ayant été traités avec des médicaments contenant des salicylates peu
de temps après une infection virale telle la grippe ou la varicelle).
Enfin il peut y avoir des effets sur le système nerveux central (céphalées, problèmes auditifs)
heureusement beaucoup moins graves que les effets précédents.
Durant des décennies, l'aspirine a été utilisée sans que l'on sache comment la molécule agissait. La
découverte de son mode d'action a été tardive et a été récompensée par le prix Nobel de physiologie
ou de médecine 1982 accordé au britannique Sir John Vane (les 2 autres colauréats, les suédois Sune
Bergström et Bengt Samuelsson, ayant travaillé sur les cibles de l'aspirine).
2. Données physico-chimiques
Masse molaire atomique :
Constante d’acidité
pKA du couple acido-basique mis en jeu : pKA (acide acétylsalicylique /ion acétylsalicylate) = 3,5 à 25°C
Solubilité
L’acide acétylsalicylique est peu soluble dans l’eau et très soluble dans l’éthanol.
Pour préparer une solution aqueuse de cet acide, on le dissout d’abord dans un peu d’éthanol (environ
10 mL), puis on ajoute de l’eau distillée pour compléter la fiole jaugée. Les excipients insolubles restent en
suspension, la solution obtenue est trouble, mais cela n’a pas de conséquence pour le dosage.
Conductivité molaire ionique
ions
H3O+
HO–
Na+
C6H5COO–
479 OHC
° (mS.m2.mol-1)
35,0
19,9
5,01
7,34
3,23
?
A savoir : les ions H3O+ et HO- ont des ° plus élevés que tous les autres ions.
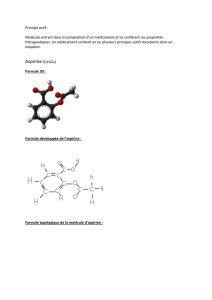
Formule topologique de l’acide acétylsalicylique
Masse molaire
M = 180 g.mol –1

4
Annexe 3 : Titrage pH-métrique d’un acide faible par une base forte
Au semestre 1, vous avez proposé un titrage d’une solution saturée d’acide benzoïque afin de déterminer la
solubilité de l’acide benzoïque dans l’eau et sa constante d’acidité.
Données :
Produit ionique de l’eau : pKe = 14
La courbe de titrage pH métrique de Va = 5,0 mL d’une solution saturée d’acide benzoïque par une solution
aqueuse de soude de concentration Cb = 1,0.10–2 mol.L –1 est rappelée ci-dessous.
1. Réaction de titrage
Ecrire l’équation de la réaction de titrage de l’acide benzoïque par la soude
Calculer sa constante d’équilibre ; cette réaction convient – elle pour un titrage ?
Ecrire la relation à l’équivalence, indiquant que les réactifs ont été introduits dans les proportions
stoechiométriques (on attribue les indices a à l’acide benzoïque et b à la soude et on note le
volume équivalent).
Compléter le tableau d’avancement de la réaction de titrage, en QUANTITE DE MATIERE : introduit (ie
après mélange mais avant réaction), après réaction (avant équivalence), après réaction (à
l’équivalence), et après réaction (après équivalence).

5
+
=
+
H2O
n introduit (après mélange mais
avant réaction)
excès
n après réaction
Avant équivalence
excès
A l’équivalence
excès
Après équivalence
excès
2. Expressions du pH de la solution en cours de titrage
Il est possible de déterminer l’évolution du pH de la solution en fonction du volume de soude versé.
METHODE :
Découper le domaine de variation de Vb en plusieurs domaines d’étude, séparés par les équivalences
successives (dans le cas étudié, une seule équivalence donc deux domaines)
Dans chaque domaine faire un bilan de matière (de la réaction de titrage) afin de déterminer la
composition de la solution après réaction (de titrage), puis en déduire l’expression du pH. Selon le
titrage étudié (titrage d’un acide fort, d’une base forte ou d’un acide faible ou d’une base faible),
plusieurs cas peuvent se présenter :
Le tableau d’avancement donne
OH3
n
, alors
total
OH
V
n
logpH 3
Le tableau d’avancement donne
HO
n
, alors
total
HO
V
n
log14pH
Le tableau d’avancement
AH
Anet n
, alors
AH
A
An
n
logpKpH
Montrer que, pour la courbe de titrage de l’acide benzoïque par la soude :
Si Vb < :
Si Vb > :
 6
6
 7
7
1
/
7
100%