TP_titrage conductimétrique des ions chlorure dans l`eau d–

T
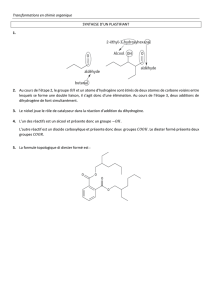
erm
S spécialité. Effectuer des contrôles de qualité.
TP .TITRAGE CONDUCTIMETRIQUE :
Détermination de la concentration des ions chlorure dans l’eau du robinet.
Objectif : - Réaliser un titrage direct par conductimétrie.
Matériel :
- conductimètre
- agitateur magnétique
- barreau aimanté
- béchers de 100 mL et 250 mL
- fiole jaugée de 250 mL
- erlenmeyer de 500 mL
- crayon à verre
Produits :
- solution S
0
de nitrate d’argent de
concentration C
0
= 1,0.10
-2
mol.L
-1
- eau du robinet
Ce sujet est accompagné d'une feuille de réponse individuelle sur laquelle vous
devez consigner vos résultats.
I) Réalisation du titrage.
- Remplir la burette avec la solution de nitrate d’argent et ajuster le zéro.
- Dans l’erlenmeyer, introduire un volume de 250 mL d’eau du robinet mesuré à la fiole
jaugée.
- Installer le conductimètre en veillant à ce que la sonde soit entièrement immergée.
- Mettre en route l’agitation magnétique.
- Procéder ensuite au titrage : ajouter mL par mL la solution titrante en notant à chaque
fois la valeur de la conductivité. Remplir le tableau fourni sur la feuille réponse.
Répondre aux questions 1 à 4 sur la feuille réponse.
II) Exploitation des résultats.
Répondre aux questions 5 à 11 sur la feuille réponse.

Feuille réponse. Nom : Prénom :
Question 1. Remplir le tableau ci-dessous.
V (mL) 0 1 2 3 4 5 6 7 8 9 10
σ ( mS.cm
-1
)
V (mL) 11 12 13 14 15 16
σ ( mS.cm
-1
)
Question 2. Réaliser un schéma légendé du dispositif de titrage.
Question 3. Ecrire l’équation de la réaction de titrage et expliquer pourquoi on qualifie ce
titrage de titrage direct.
Question 4. Quelle est l’espèce solide qui, au cours du titrage, apparaît progressivement en
suspension dans la solution ?
Question 5. Tracer le graphique représentant l’évolution de la conductivité en fonction du
volume de solution titrante versée.
Question 6. Comment repère-t-on l’équivalence et donner la valeur de V
eq
.

Question 7. Préciser les espèces présentes en solution avant l’équivalence, à l’équivalence
et après l’équivalence.
Question 8. En utilisant les valeurs des conductivités molaires ioniques, justifier l’évolution
de la conductivité.
λ(Ag
+
) = 61,9.10
-4
S.m
2
.mol
-1
λ (
3
NO
−
) = 71,4.10
-4
S.m
2
.mol
-1
λ (Cl
-
) = 76,3.10
-4
S.m
2
.mol
-1
Question 9. A l’aide d’un tableau d’avancement, déterminer la quantité d’ions chlorure dans
la prise d’essai.
Question 10. En déduire la concentration molaire puis la concentration massique en ions
chlorure de l’eau du robinet titrée.
M(Cl) = 35,5 g.mol
-1
.
Question 11. La législation française fixe à 200 mg.L-1 la concentration maximale en ions
chlorure dans une eau destinée à la consommation. L’eau étudiée ici est-elle conforme à la
législation ?
1
/
3
100%