Revue de la littérature Hépato-gastro

« Ce que nous savions, ce que nous faisions…
Ce que nous avons appris, ce que nous devrions faire »
R e v u e d e m é d e c in e g é n é r a l e f o n d é e s u r l e s p r e u v e s
N°56 - Juin 2011
Maladies inammatoires du tube digestif :
maladie de Crohn et rectocolite hémorragique (p. 4)
Appropriation par le médecin de famille des termes de la loi sur
le droit des malades et la n de vie, dite « Loi Léonetti » (p. 15)
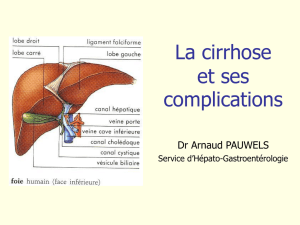
Cirrhose compensée :
dépistage et surveillance (p. 8)
Revue de la littérature
Comment peut-on explorer le colon en 2011 ? (p. 12)
Hépato-gastro-entérologie
Déontologie - Réflexion

ONBREZ BREEZHALER 150 µg, 300 µg Poudre pour inhalation en gélules (indacatérol) FORME, PRÉSENTATION ET COMPOSITION Poudre pour inhalation en gélule dosée à 150 µg ou 300 µg d’indacatérol sous forme de maléate d’indacatérol.
Dose délivrée par l’embout buccal de l’inhalateur Onbrez Breezhaler : 120 µg (pour dosage 150 µg) ou 240 µg (pour dosage 300 µg) d’indacatérol sous forme de maléate d’indacatérol. DONNÉES CLINIQUES Indications thérapeutiques Onbrez
Breezhaler est indiqué en traitement bronchodilatateur continu de l’obstruction des voies respiratoires chez les patients adultes atteints de broncho-pneumopathie chronique obstructive (BPCO). Posologie - mode d'adm. Dose recommandée :
inhalation du contenu d’une gélule de 150 µg 1 fois par jour à l’aide de l’inhalateur Onbrez Breezhaler. La posologie ne doit être augmentée que sur avis médical. L’inhalation du contenu d’une gélule de 300 µg 1 fois par jour à l’aide de
l’inhalateur Onbrez Breezhaler peut apporter un bénéfice clinique supplémentaire pour diminuer l’essoufflement, en particulier chez les patients atteints de BPCO sévère. La dose maximale préconisée est de 300 µg 1 fois par jour. Onbrez
Breezhaler doit être administré quotidiennement à heure fixe dans la journée. En cas d’omission d’une dose, la dose suivante doit être prise à l’heure habituelle le lendemain. Pas d’ajustement posologique chez les patients âgés. Pas
d’indication spécifique pour l’utilisation d’Onbrez Breezhaler chez les enfants et adolescents (en dessous de 18 ans). Pas d’ajustement posologique chez les patients présentant une insuffisance hépatique légère à modérée. Pas de données
concernant l’administration d’Onbrez Breezhaler chez les patients atteints d’insuffisance hépatique sévère. Pas d’ajustement posologique chez les patients présentant une insuffisance rénale. Mode d’adm. Pour inhalation seulement. Les gélules
Onbrez Breezhaler doivent être administrées en utilisant uniquement l’inhalateur Onbrez Breezhaler. Les gélules Onbrez Breezhaler ne doivent pas être avalées. Contre-indications Hypersensibilité à la substance active, au lactose ou à l’un
des autres excipients. Mises en garde spéciales et précautions particulières d'emploi Ne pas utiliser chez les patients asthmatiques compte tenu de l’absence de données à long terme dans le traitement de l’asthme. L’inhalation peut entraîner
un bronchospasme paradoxal pouvant engager le pronostic vital. En cas de bronchospasme paradoxal, le traitement doit être arrêté immédiatement et remplacé par un autre traitement. Pas d’indication en traitement de secours, c’est à dire
dans le traitement des épisodes aigus de bronchospasme. En cas d’aggravation de la BPCO pendant le traitement, l’état du patient et la conduite thérapeutique de la BPCO devront être réévalués. La dose quotidienne ne doit pas excéder la
dose maximale de 300 µg. Prudence chez les patients présentant des affections cardiovasculaires (maladie coronarienne, infarctus aigu du myocarde, arythmies, hypertension), chez les patients présentant des épisodes convulsifs ou une
thyrotoxicose et chez les patients présentant une réponse idiosyncrasique aux agonistes bêta-2-adrénergiques. L’indacatérol peut provoquer chez certains patients des effets cardiovasculaires cliniquement significatifs, se manifestant par
des augmentations de la fréquence cardiaque et de la pression artérielle et/ou des symptômes. Dans ce cas, il peut être nécessaire d’interrompre le traitement. Les agonistes bêta-2-adrénergiques peuvent induire chez certains patients une
hypokaliémie significative, qui peut entraîner des effets indésirables cardiovasculaires. La diminution de la kaliémie est généralement transitoire et ne nécessite pas de supplémentation. Chez les patients présentant une BPCO sévère, les
effets hypokaliémiants peuvent être potentialisés par l’hypoxie et par des traitements concomitants, ce qui peut accroître la prédisposition aux arythmies cardiaques. L’inhalation de doses élevées d’agonistes bêta-2-adrénergiques peut entraîner
des élévations de la glycémie. La glycémie doit être surveillée plus étroitement chez les patients diabétiques après l’instauration du traitement. Interactions avec d'autres médicaments et autres formes d'interactions Onbrez Breezhaler ne
doit pas être utilisé en association avec d’autres agonistes bêta-2-adrénergiques à longue durée d’action ou avec des médicaments contenant des agonistes bêta-2-adrénergiques à longue durée d’action. L’effet hypokaliémiant possible des
agonistes bêta-2-adrénergiques peut être potentialisé en cas de traitement concomitant par des agents hypokaliémiants tels que les dérivés de la méthylxanthine, les corticoïdes ou les diurétiques non épargneurs de potassium, ceux-ci devront
donc être utilisés avec précaution. Pas d’administration avec des bêta-bloquants (y compris des collyres) à moins d’une nécessité absolue. Si leur utilisation s’avère indispensable, il est préférable d’utiliser des bêta-bloquants cardiosélectifs,
mais ils devront être administrés avec prudence. Interactions métaboliques et avec les transporteurs L’inhibition des principaux responsables de l’élimination de l’indacatérol, le CYP3A4 et la glycoprotéine P (Gp) multiplie par près de 2 fois
l’exposition systémique à l’indacatérol. L’amplitude de l’augmentation de l’exposition due à des interactions n’entraîne pas de risque. Grossesse et allaitement Ne doit être utilisé pendant la grossesse que si les bénéfices attendus l’emportent
sur les risques potentiels. Interrompre l’allaitement ou d’interrompre/suspendre le traitement, en prenant en considération le bénéfice de l’allaitement pour l’enfant et le bénéfice attendu du traitement pour la mère. Effets indésirables Synthèse
du profil de sécurité d'emploi Les effets indésirables les plus fréquents aux doses recommandées ont été : rhinopharyngite (9,1 %), toux (6,8 %), infections respiratoires hautes (6,2 %) et céphalées (4,8 %). Dans la plupart des cas, ils ont
été d’intensité légère ou modérée et leur fréquence diminuait avec la poursuite du traitement. Les effets indésirables fréquents F (≥ 1/100, < 1/10), peu fréquents PF (≥ 1/1 000, < 1/100) sont présentés ci-dessous : F : Rhinopharyngite,
Infection respiratoire haute, Sinusite, Diabète et hyperglycémie, Céphalées, Cardiopathie ischémique, Toux, Douleur laryngopharyngée, Rhinorrhée, Congestion des voies Respiratoires, Spasmes musculaires, Œdème périphérique PF : Paresthésies,
Fibrillation auriculaire, Douleur thoracique non cardiaque PROPRIÉTÉS PHARMACOLOGIQUES
Propriétés pharmacodynamiques Classe pharmacothérapeutique : Agonistes bêta-2-adrénergiques de longue durée d’action, code ATC : R03AC18.
Instructions pour l’utilisation, la manipulation et l’élimination : se référer au RCP complet Liste I Onbrez Breezhaler 150 µg : EU/1/09/593/001 (16.06.2010) ; CIP 399 821-7 – Boîte de 10 gélules + 1 inhalateur Onbrez Breezhaler 150 µg :
EU/1/09/593/002 (16.06.2010) ; CIP 399 822-3 – Boîte de 30 gélules + 1 inhalateur Onbrez Breezhaler 300 µg : EU/1/09/593/006 (16.06.2010) ; CIP 399 824-6 – Boîte de 10 gélules + 1 inhalateur Onbrez Breezhaler 300 µg :
EU/1/09/593/007 (16.06.2010) ; CIP 399 825-2 – Boîte de 30 gélules + 1 inhalateur Spécialités Non Remb. Séc. Soc.- Non Agréé Collect à juin 2010 (demande d'admission à l'étude) Novartis
Pharma S.A.S. 2 et 4, rue Lionel Terray 92500 Rueil-Malmaison Tél : 01.55.47.60.00 Information médicale : Tél : 01.55.47.66.00 [email protected] "Pour une information complète,
consulter le texte intégral du résumé des caractéristiques du produit, soit sur le site internet de l'Afssaps si disponible, soit sur demande auprès du laboratoire.
" FMI091-5
V3720 - Mars 2011
TRAITEMENT BRONCHODILATATEUR CONTINU DE L’OBSTRUCTION DES VOIES RESPIRATOIRES CHEZ
LES PATIENTS ADULTES ATTEINTS DE BRONCHO-PNEUMOPATHIE CHRONIQUE OBSTRUCTIVE (BPCO)
Spécialités disponibles et non remboursées à mars 2011
Onbrez® Breezhaler® ne doit pas être utilisé dans le traitement de l'asthme
compte tenu de l'absence de données à long terme dans cette indication.
La dose recommandée est l'inhalation du contenu d'une gélule de 150 micro-
grammes une fois par jour à l'aide de l'inhalateur Onbrez® Breezhaler®.
La posologie ne doit être augmentée que sur avis médical.
Une nouvelle source d’Inspiration dans la BPCO*
Traitement de 1ère intention
chez les patients dont la gêne respiratoire est devenue permanente, malgré l’utilisation pluriquotidienne d’un bronchodilatateur de courte durée d’action (1)
* Broncho-Pneumopathie Chronique Obstructive.
(1) Avis de la Commission de la Transparence du 15 12 2010.
Il existe des alternatives médicamenteuses.
L’inhalateur Onbrez® Breezhaler®permet d’inhaler le médicament contenu dans une gélule d’Onbrez® Breezhaler®
V3720-Info Respiration 210x297_1 01/04/11 10:06 Page1

Editorial
Membres des comités :
M. ARNOULD, Strasbourg
E. AZOGUI, Marseille
M. BACHELET, Saint Sebastien / Loire
J. BARANGER, Clermont Ferrand
S. BENDAVID, Paris
S. BENICHOU, Beaulieu
C. BERRARD, Poitiers
M. BISMUTH, Labarthe sur Leze
E. BOTBOL, Strasbourg
O. BOURGEOIS, Saint Orens de Gameville
Y. BOURHIS, Nantes
E. BOURROUNET, Vinassan
C. BRONNER, Strasbourg
M. CARRERE, Montferrier Sur Lez
D. CASELLES, Nice
C. CAZARD, Lherm
C. CHARANI, Roubaix
J-N. CHARPY, Lyon
E. CHARRE, Le Cannet
J. CLAVERO, Paris
J-N.COEROLI, Marseille
G. DAHAN, Nantes
P. DESOBRY, Warloy Baillon
P. DESPREZ, Caen
J-M. DEVIENNE, Lille
T. DUBON, Bordeaux
D. DUBOURG, Saint Viaud
G. DUCOS, Pessac
M. DUCROS, Reims
G. DUROUX, La Teste De Buch
G. ERRIEAU, Paris
S. FERRACCI, Marmande
J-J. FERRON, Nantes
A. FIORLETTA, Rombas
B. FOURRIER, Cesson-Sevigne
L. FRYDMAN, Montpellier
J-P. GARMY, Cusset
B. GARRIGUE, Chauvigny
J-B. GASC, Marseille
P. GELLIE, Pessac
M-F. GERARD, Vicherey
F. GHISONI, Plan Du Var
M-J. GILBERT, Romagnat
J-M. GRALL, Ploudiry
X. GRALL, Brest
G. GRANET, Ste Foy lès Lyon
P. GUY, Dompierre Sur Besbre
G. HAMONIC, Pleudihen Sur Rance
S. HARMANT, Pau
G. HASSID, Paris
M. HILFIGER, Saint Etienne Du Bois
B. JEFFREDO, Bains Sur Oust
P. LABURTE, Metz
J-P. LARRUMBE, Velaux
P. LAUWICK, Roubaix
B. LEFRANCQ, Lille
J-M. LETZELTER, Strasbourg
A. LEVY, New York
B. LOUIS, Villeurbanne
J-C. LUCAS, Portet Sur Garonne
S. LUTIAU, Reze
G. LYON, Paris
E. MAGNIERE, Montlucon
P. MARIE, Cormelles
V. MASSON, La Madeleine
A. MASSONNEAU, Saint Sebastien / Loire
H. MAUBON, Nimes
D. MAUFROY, Paris
M. MELTZ, Lyon
P. NAUDE, Seichamps
J-L. NOEL, St Germain du Corbeis
J-L. NOTINI, Caen
A. NOUAILLES, Saint Erme Outre et Ramecourt
D. PAREZ, Concarneau
J-L. PECQUEUX, Epinal
H. PENAUD, Liguge
J-B. PERREIN, Bordeaux
J-F. PERROCHEAU, Cherbourg Octeville
P. PETERS, Narbonne
A. PROCHASSON, Metz
P. PRUAL, Rennes
J. RAMBAUD, Bompas
G. RECORBET, Marseille
B. REGNAULT, Granville
D. RICHTER, Jarny
J-C. ROBERT, Villers sur Mer
J. ROSSANT LUMBROSO, Nice
B. ROUALET, Troyes
F. ROYER, Essey les Nancy
M. RUETSCH, Dessenheim
J-Y. SCHLIENGER, Cormicy
F. SCHMITT, Joue les Tours
D. SIMON, Carignan
P. TERRET, Rennes
G. THUILIER, Paris
G. VAN QUI, Toulouse
J-Y. VOGEL, Husseren Wesserling
P. VOGT, Mulhouse
R. WANG, St Max
D. WEIL, Hangenbieten
G. ZERBE, Gennes
N° 56 - Juin 2011
Patrick DUCREY - Directeur de la publication
Pour vous inscrire, consulter nos programmes, consulter les différents numéros de la revue,
vous pouvez vous connecter à notre site Internet www.preuvesetpratiques.com
Éditeur
Régifax
45-47, rue d’Hauteville
75010 Paris
Tél. : 01 47 70 00 96
Fax : 01 48 24 15 39
Directeur de la publication
Patrick DUCREY
Rédacteur en chef
François PHILIPPE
Comité de lecture
E. AZOGUI, Marseille
S. BENICHOU, Beaulieu
M. BISMUTH, Labarthe sur Leze
Y. BOURHIS, Nantes
D. CASELLES, Nice
C. CHARANI, Roubaix
J-N. COEROLI, Marseille
P. DESPREZ, Caen
T. DUBON, Bordeaux
B. ESCOURROU, Le Fossat
C. FRYDMAN, Montpellier
G. GRANET, Ste-Foy-lès-Lyon
P. LAUWICK, Roubaix
B. LEFRANCQ, Lille
A. LEVY, New York
M. MELTZ, Lyon
J. RAMBAUD, Bompas
G. RECORBET, Marseille
B. REGNAULT, Granville
D. RICHTER, Jarny
J. ROSSANT Lumbroso, Nice
M. RUETSCH, Dessenheim
G. VAN QUI, Toulouse
J-Y. VOGEL, Husseren Wesserling
Coordination de la rédaction
Solenne LE BOHEC
Prix de la revue au numéro : 10 €
Abonnement
(1 an - 4 numéros)
France / Etranger : 40 €
Bimestriel réservé au corps médical
Dans ce numéro,
présence de documents asilés
Tirage : 21.000 exemplaires
Conception : Agence CCC
PAO : Editiel Ltée
Impression : De Bussac, France Pour vous inscrire, consulter nos programmes, consulter les différents numéros de la revue,
vous pouvez vous connecter à notre site Internet www.preuvesetpratiques.com
l’occasion de ce 56ème numéro de cette revue, le signataire des éditoriaux des 55 numéros précédents
et fondateur de Preuves & Pratiques, Alain SEBAOUN, m’a passé le flambeau opérationnel de cette
aventure qui fédère et crée, grâce à l’Association des Rencontres Médicales Pluridisciplinaires
Preuves & Pratiques présidée par Guy THUILIER, des projets de formation et d’information exclusivement
destinées aux médecins généralistes.
Au cours des 9 années de notre collaboration, j’ai accompagné Alain SEBAOUN qui a fait preuve d’une inlassable
persévérance pour trouver les moyens de mettre sur pied des projets de formation ambitieux et pertinents qui ont
abouti à faire de Preuves & Pratiques un acteur important de la formation des médecins généralistes.
Qu’il trouve ici les justes remerciements qui lui sont dus !
Dans ce numéro consacré majoritairement à l'hépato-gastro-entérologie, vous trouverez des mises au point sur les
MICI et la cirrhose ainsi qu’une revue de la littérature sur l’exploration du colon. Vous trouverez aussi, et c’est une
première, un article de réflexion sur le loi Léonetti.
Nous vous proposons depuis peu un nouvel outil d’information mensuel qui rencontre un succès croissant,
le webjournal P&P de 30 minutes, en direct un jeudi soir par mois à 20h30 sur www.preuvesetpratiques.com.
N’hésitez pas à vous connecter !
Nous vous donnons rendez-vous en septembre et octobre pour vos prochains congrès Preuves & Pratiques
régionaux à Clermont-Ferrand, Nantes, Rennes et Bordeaux.
Bonne lecture,
Patrick DUCREY ■
P&P au service de la formation des généralistes
A

Maladies inflammatoires du tube digestif :
maladie de Crohn et rectocolite hémorragique
Du traitement des symptômes au concept de
« cicatrisation muqueuse » et à la prévention du cancer
La connaissance des maladies inammatoires chroniques de l'intestin évolue rapidement
à la lumière de nouvelles notions épidémiologiques, physiopathologiques et surtout
thérapeutiques qui bouleversent la prise en charge de ces patients souvent jeunes.
Le développement des traitements en continu et une surveillance beaucoup plus précise
des critères de guérison, mais aussi des effets secondaires, vont transformer l'implication
des médecins traitants dans le suivi de ces pathologies chroniques.
Docteur Philippe AYGALENQ, Grasse*
4Hépato-gastro-entérologie
Preuves :
Ce que nous savions
L
es maladies inflammatoires
chroniques de l’intestin
(MICI) sont des atteintes
inflammatoires du tube digestif évo-
luant par poussées symptomatiques.
De cause inconnue, elles ont un pic
de survenue entre 15 et 35 ans. L’inci-
dence de la maladie de Crohn (MC)
semble en augmentation (12/100 000),
celle de la rectocolite hémorragique
(RCH) reste stable (11/100 000). La MC
peut toucher l’ensemble du tube diges-
tif, avec une prédominance pour l’iléon
et/ou le colon, la RCH n’atteint que le
colon. Un tiers des malades vont pré-
senter des atteintes extradigestives
(rhumatologiques, hépatiques, cutanés,
thrombotiques…). Le traitement est
resté basé jusqu’à peu sur le principe
du « step up », passant du traitement le
plus simple vers le plus puissant, en
réservant le recours à la chirurgie aux
échecs du traitement médical, ou lors
d’une complication septique aiguë.
Premier traitement, les 5-ASA sont peu
efficaces dans le traitement d’attaque
de la MC (en dehors des formes iléales
pures) mais restent efficaces dans le
traitement et la prévention des pous-
sées de RCH. Lorsqu’ils sont insuffi-
sants, le traitement d’attaque des crises
reposait le plus souvent sur une cortico-
thérapie locale ou générale de 2 à
3 mois, efficace sur les symptômes
mais incapable de modifier l’histoire
naturelle (taux de récidives, complica-
tions). Il était recommandé de suivre
l’amélioration des symptômes, mais la
cicatrisation des lésions muqueuses
vues en endoscopie (inflammation,
ulcération) n’était pas contrôlée. Plu-
sieurs études ont néanmoins montré
que ces lésions histologiques pouvaient
persister sous corticoïdes malgré
l’amélioration, voire la disparition, des
symptômes cliniques. La signification
péjorative de cette persistance de
lésions tissulaires sur l’évolution est
restée longtemps discutée. Dans les
formes rebelles ou multi-récidivantes, la
corticothérapie orale devait être arrêtée,
en raison de ces effets secondaires
au long cours. Le recours à des traite-
ments d’entretien par immunosup-
presseurs (azathioprine, méthotrexate,
1990) puis par les anti-TNF alpha
(infliximab 1999, adalimumab, 2008)
s’est donc développé pour concerner
aujourd’hui 60 % des patients. Ces trai-
tements, une fois installés et efficaces,
sont poursuivis pour de nombreuses
années, peut-être à vie, du fait d’un
taux de rechutes élevées à l’arrêt.
De plus en plus de médecins traitants
sont et seront donc amenés à suivre
et à surveiller des MICI sous immuno-
suppresseurs ou anti-TNF alpha.
Il reste que ces 2 pathologies sont
responsables d’une morbidité impor-
tante avec une diminution de la qualité
de vie et des séquelles fonctionnelles
dans les formes évoluées ou opérées.
La gestion du traitement a donc été
revue à la lumière de nouveaux tra-
vaux sur ces traitement immunosup-
presseurs et anti-TNF. Par ailleurs, un
sur-risque néoplasique colique a été
confirmé dans ces 2 maladies, sur-
tout lorsqu’elles touchent l’ensemble
du colon formant une « pancolite ».
Ce risque semble corrélé à la durée
d’évolution et à l’extension colique de
l’atteinte inflammatoire.
Ces deux sujets ont fait l’objet de don-
nées nouvelles, qui modifient la prise
en charge et la surveillance de ces
patients au cabinet du médecin traitant.
Preuves :
Ce que nous avons appris
Concernant l’efficacité des nou-
veaux traitements sur l’évolution
des MICI
Le caractère récidivant et invalidant
de ces pathologies est confirmé : de
larges études de cohortes récentes
ont précisé le caractère récidivant et
invalidant de ces maladies. Dans la MC,
le risque de recours à la chirurgie est
de 24 % dans l’année qui suit le
diagnostic, de 50 % dans les 10 ans
qui suivent le diagnostic. Seul 10 % des
malades atteints de MC n’ont qu’une
poussée dans leur vie. Dans la RCH,
seuls 25 % des patients n'ont pas
eu de rechute 7 ans après la date du
diagnostic ; à l’inverse, 18 % ont plus
d’une poussée par an. Sur l'ensemble
des RCH, 16 % ont recours à une
chirurgie à 10 ans, ce chiffre passant
à 35 % de colectomie totale chez les
patients qui ont une atteinte de tout
le colon (pancolite).
La mauvaise surprise est venue des
études de population montrant que
ce recours à la chirurgie n’avait
pas diminué entre les années 1980
et 2005 malgré l’amélioration de la
prise en charge et l’utilisation des
immunosuppresseurs et des anti-
TNF alpha.

5
44
Maladies inammatoires du tube digestif : maladie de Crohn et rectocolite hémorragique
Du traitement des symptômes au concept de « cicatrisation muqueuse » et à la prévention du cancer
Ces notions sont venues étayer
l’idée qu’il ne s’agit pas de maladies
périodiques évoluant par poussées
entrecoupées de phase de retour ad
integrum, mais bien d’une évolution
inflammatoire chronique, aboutis-
sant à la « destruction intestinale »
définitive. Cette idée est particulière-
ment adaptée à la MC où les malades
passent du phénotype inflammatoire
au début de leur maladie, vers le
phénotype perforant (fistule) et/ou
sténosant, beaucoup moins sen-
sible aux traitements médicaux, qui
agissent surtout sur la composante
inflammatoire. Ceci expliquerait
l’absence de diminution du recours
à la chirurgie dans les études rétros-
pective en population, car les immu-
nosuppresseurs et les anti-TNF ont
été prescrits initialement sur des
formes multi-récidivantes et évo-
luées, moins sensibles à ces traite-
ments. Les études récentes sur des
formes débutantes traitées d’emblée
par anti-TNF, montrent que ces trai-
tements diminuent significativement
à la fois les récidives, mais aussi
le recours à la chirurgie. Cette
théorie aboutit au concept dit
du « step-down » où les patients
sont traités par un traitement
puissant : anti-TNF +/- dès la
première poussée avec critère de
gravité ou dès la première récidive
requérant la corticothérapie avec
des résultats qui semblent meilleurs
en terme d’efficacité clinique
et histologique. Etudiés initiale-
ment dans les séries pédiatriques,
ce concept s’étend aujourd’hui
aux formes adultes pour éviter au
maximum le recours itératif aux
corticoïdes, dont on sait mainte-
nant qu’ils ne sont que des traite-
ments suspensifs. Le traitement est
ensuite laissé en entretien avec une
seule des classes thérapeutiques :
immunosupresseurs ou anti-TNF.
Cette attitude est renforcée actuelle-
ment par le recul du suivi des effets
secondaires de ces traitements et
notamment le résultat d’une cohorte
française : CESAME, qui a regroupé
plus de 12 000 MC et 8 000 RCH.
Ces travaux sont en faveur d’une
bonne tolérance sous réserve d’un
risque faible, infectieux, mais aussi,
néoplasique (lymphome, cancer
cutanées et génitaux). Ces traite-
ments doivent donc s’accompagner
d’un suivi étroit qui concerne direc-
tement le médecin traitant.
Les recommandations actuelles
précisent les indications, contre-
indications et modalités de suivi de
ces traitements (Consensus euro-
péen ECCO2-3). L’évolution ultime du
concept « step-down » est celui de
la « cicatrisation muqueuse », cher-
chant à obtenir une amélioration
symptomatique mais aussi une dis-
parition de l’inflammation muqueuse
sous traitement. Ceci est indiqué
pour l’instant dans le suivi post
chirurgical des MC où l’on recom-
mande une coloscopie systématique
entre 6 mois et un an après la chirur-
gie chez les sujets asymptomatiques
sous traitement. Dans les études
sur les immunosuppresseurs et les
anti-TNF, la cicatrisation muqueuse
est aujourd’hui le meilleur indice
pronostique évolutif, notamment en
termes de diminution du recours
à la chirurgie. Il est donc possible
à l’avenir que la surveillance des
malades soit plus intensive, recher-
chant la cicatrisation muqueuse soit
par des examens morphologiques
systématiques (entéro-IRM, endos-
copies) et/ou avec des marqueurs
biologiques qui ne sont pas encore
validés (type : calprotectine fécale ?).
Risque de cancer colique chez les
patients ayant une MICI
Les patients atteints de MICI sont une
population à risque élevé de can-
cer colorectal. Initialement décou-
vert sur les RCH, ce risque est en fait
dépendant de l’étendue des lésions
coliques que ce soit une RCH ou une MC,
avec un sur-risque important pour ceux
dont tout le colon est atteint (pancolite).
Ce sur-risque fait qu’un patient jeune
de 40 ans qui a 20 ans d’évolution
d’une RCH a deux fois plus de risque
d’avoir un cancer du colon qu’un
homme de 70 ans1 (QS Schéma).
Risque de cancer RCH / durée
d’évolution
La notion nouvelle est que les amino-
salicylés, essentiellement les 5-ASA en
France, sont des agents préventifs de
ce sur-risque. Donnés en traitement
d’entretien de la RCH et de la MC, ils
ont montré une diminution de moitié
du risque de cancer à condition qu’ils
soient pris régulièrement. Cette donnée
a été reprise dans le dernier consen-
sus européen (ECCO) et a donné lieu
à une extension d’AMM de certaines de
ces spécialités. Il faut donc s’employer
à expliquer l’intérêt de ces traitements
et de leur prise régulière à vie. L’autre
notion nouvelle est qu’un suivi endos-
copique systématique est recommandé
dans les MICI, en dehors des poussées
symptomatiques. Ces endoscopies
explorent la totalité de la muqueuse
colique en s’aidant de colorations
vitales et de biopsies systématiques
étagées. La recherche de dysplasie
est un marqueur essentiel, pouvant
imposer une colectomie préventive.
En effet, le taux de cancer retrouvé
sur un colon opéré après une biop-
sie avec une dysplasie de haut grade
est de 42 %. Cette surveillance
vous est détaillée dans le chapitre
Pratiques.
5
Infections Affections malignes
Azathioprine EBV, CMV
HPV, Herpès
Cancers spino-, baso-cellulaires
Lymphome
Méthotrexate EBV Lymphome
Ciclosporine Pneumocystis, aspergillus Cancersspino-cellulaires
Lymphome, Kaposi
Anti-TNF BK, mycobactéries
Legionella, pneumocystis, listeria
Lymphome
Cancers spino-, baso-cellulaires
Tableau 1 : Risque principaux des patients sous immuno-suppresseurs ou sous
anti-TNF alpha (D’après Pr J Cosnes)
20%
0%
5%
0,10%
2%
8%
18%
Homme 70 ans
RCH ayant débuté à 20 ans
Risque de cancer RCH / durée d’évolution
Homme 70 ans
RCH à 30 ans
RCH à 50 ans
Homme 50 ans RCH à 30 ans RCH à 40 ans RCH à 50 ans
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%