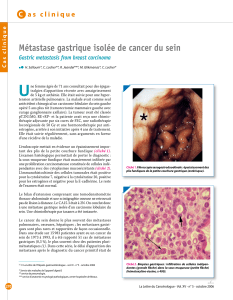
Métastases musculaires

Métastases musculaires
J ALEXIOU, M MULAJ, JL ENGELHOLM
Institut Bordet, ULB
Bruxelles

Introduction
• Le développement de métastases est une
des complications les plus dramatiques du
cancer.
• Néanmoins, alors que les muscles
constituent 40 à 50 % de la masse
corporelle, l’atteinte tumorale primitive est
relativement rare et encore plus rare pour
les localisations secondaires

Mode de dissémination
• Le type de dissémination métastatique dépend des propriétés des
cellules tumorales, des différences biologiques des organes et de la
variété des mécanismes immunologiques et non immunologiques
de l’hôte[11,23,27].
• Au niveau musculaire, on incrimine différentes causes responsables
du faible développement métastatique. Parmi celles-ci, on peut citer
les variations du flux sanguin, l’acide lactique, des inhibiteurs
enzymatiques et des protéases, l’hyperoxie. La dénervation ainsi
que l’immunité cellulaire et humorale de l’hôte tout comme les
propriétés de surface des cellules sont également importantes
[27,30,32,33,36].
• Il a été aussi montré qu’un traumatisme pouvait favoriser le
développement de métastases notamment par adhérence accrue
des cellules tumorales à l’endothélium vasculaire endommagé,
altération du flux et de la coagulation [1,6,12].

Incidence
• Elle varie en fonction des séries d’autopsie entre moins
de 1% jusqu’ à plus de 50 %.
• Cette variabilité s’explique par la différence de méthode
de chaque étude ( échantillonnage de 1-2 jusque 12
muscles) et par le type de tumeur analysée : l’auteur
ayant la fréquence la plus élevée n’a investigué que des
lymphomes et des leucémies et a également compté des
lésions microscopiques [5,24,38].
• Les statistiques sont aussi biaisées par l’absence
d’analyse systématique des membres lors des
nécropsies et par la difficulté à investiguer tous les
muscles.
• Toutefois, on considère que l’incidence des métastases
musculaires est de moins de 1% .

Incidence
• Les cancers donnant le plus souvent des
métastases squelettiques sont ceux du
poumon, du rein et du colon [8,13,29].
• D’autres primitifs comme l’utérus,
l’œsophage, la thyroïde,… sont rares et
font souvent l’objet de case report
[10,19,21,25,31,33,34].
• Les acrométastases musculaires sont
excessivement rares[20].
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
1
/
57
100%