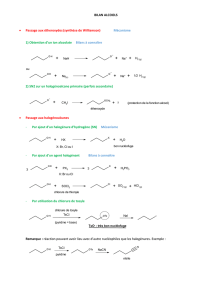
Proposition de Laurent Larroche

Montage N°1
Expériences illustrant les propriétés chimiques des alcools.
Note pour tous les montages: Les thèmes étant très large, il faut un fil conducteur. Le montage ne doit pas être une série
de manipulation sur un thème. Mais plutôt un ensemble cohérent se rapprochant plus d’une leçon effectuée devant une
classe. Il faut donc établir un plan précis et faire des expériences qui viendront montrer des propriétés.
Généralités sur les alcools: Un alcool est un composé organique dans lequel un hydroxyle -OH est fixé sur un atome de
carbone tétragonal. La formule générale d’un alcool est souvent notée R-OH.
Les différentes classes d’un alcool: L’alcool est dit
primaire, si le carbone fonctionnel est lié à un (ou zéro) atome de carbone;
secondaire, si le carbone fonctionnel est lié à deux atomes de carbone;
tertiaire, si le carbone fonctionnel est lié à trois atomes de carbone.
Introduction
I Détermination de la classe d’un alcool
manip: Test de Lucas. (SN 1)
matériel: 3 tubes à essais, Un erlenmeyer, 4 pipettes pasteur ; bec bunsen ; pince en bois
produits: HCl concentré ; ZnCl2 anhydre ; Butanol Iaire ; IIaire ; IIIaire
Dans cette manipulation on utilise la réactivité de la liaison C-O
Préparation du réactif (ne se conserve pas)
Dans un erlenmeyer, introduire 10 ml d’HCL concentré et une spatule de Chlorure de Zinc anhydre (ZnCl2) de façon à
saturer l’acide. Agiter ; décanter.
Répartir dans 3 tubes le réactif.
Ajouter dans le tube 1, 1ml d’alcool primaire: Il ne se passe rien
Ajouter dans le tube 2, 1ml d’alcool secondaire: Démixtion lente
Ajouter dans le tube 3, 1ml d’alcool tertiaire: Démixtion rapide, le chlorure d’alkyle se forme instantanément.
Ce test permet d’illustrer la substitution nucléophile du groupement OH d’un alcool par un anion chlorure et de
différencier les 3 classes d’alcools en comparant les vitesses d’halogénation des alcools tertiaires, secondaires et
primaires.
ROH + Cl- + H+ RCl + H2O
La formation du dérivé halogéné est détecté par suite de son insolubilité dans le milieu aqueux de départ. Cette
insolubilité peut être mise en évidence par une démixtion (apparition de deux phase) mais aussi par la présence d’une
émulsion dans le tube.
Avec les alcools tertiaires la démixtion est quasi immédiate
Avec les alcools secondaires elle est plus lente, il sera nécessaire de chauffer le tube afin de l’observer.
Avec les primaires elle est très lente, même un chauffage intensif ne la mettra pas en évidence. (Il ne faut pas hésiter à
chauffer longtemps).
Remarque:
1) ajouter l’alcool dans le réactif, et non l’inverse car le chlorure d’alkyle formé est soluble dans l’alcool, mais pas dans
le réactif.
2) Il faut utiliser du ZnCl2 anhydre (pulvérulent). En effet ZnCl2 est très hygroscopique et s’il est hydraté, les sites de
coordination seront occupés par l’eau et ne seront plus disponibles pour coordiner l’alcool.
a partir de ZnCl2 hydraté, il est possible de régénérer du ZnCl2 anhydre par chauffage sous la hotte dans un tube a essai.
Introduire le ZnCl2 hydraté et chauffer le tube avec précaution. Dans un premier temps le tube “ mousse ” par suite de
l’ébullition de l’eau. Quand la plus grande partie de l’eau est évaporé le ZnCl2 se solidifie. Prolonger le chauffage
jusqu’à fusion de ZnCl2 et jusqu’à ce qu’aucune bulle ne se forme plus à la surface du liquide. Verser le contenu dans
un mortier et piler le solide formé. Puis le transférer rapidement dans un flacon hermétique.
3) Attention aux produits volatiles inflammables. Une solution possible est de faire les tests en plongeant les tubes dans
un bécher contenant de l'eau bouillante préparée au préalable. Les réactions sont un peu plus longues mais cela a
l'avantage de manipuler en l'absence de flamme.

II Acidité des alcools.
1) selon Bronsted
manip: action du sodium sur des alcools de différentes classes.
matériel: 3 tubes à essai avec des bouchons percé; trois tubes coudés; une cuve à eau; 3 tubes à essai
produits: Butanol Iaire ; IIaire ; IIIaire ; sodium ; phénolphtaléïne
Dans cette manipulation on utilise la mobilité de l’hydrogène du groupement OH
2 ROH + 2 Na 2 RO- + 2 Na+ + H2
Introduire le sodium dans les mêmes proportions dans chaque tube à essais contenant respectivement chacun des
alcools. Boucher les tubes avec un bouchon muni d’un tube coudé comme indiqué sur le schéma. Recueillir le
dihydrogène sur cuve à eau.
La réaction se produit dans chaque tube, mais la cinétique est lente. La réactivité des alcools est d’autant plus grande
que leur acidité est importante. Ainsi l’alcool primaire réagira mieux que l’alcool tertiaire.
alcool
Iaire
IIaire
IIIaire
pKa
16
17
19
On pourra caractériser H2 par sa combustion caractéristique et les bases RO- par de la phénolphtaléïne
remarque:
1) pour caractériser le dihydrogène, laisser d’abord purger l’appareil.
2) Ne faire le test au dihydrogène qu’après la cuve à eau. En effet les vapeurs d’alcool sont retenues par l’eau.
3) Cette manipulation met en jeu deux composé dangereux : Le sodium et le dihydrogène.
4) Le papier et le matériel ayant servi au prélèvement du sodium doivent être plongés dans un bécher contenant de
l’alcool à 95° afin de détruire d’éventuels résidus de sodium.
5) la réaction ROH + Na est une réaction d’oxydo réduction mettant en évidence les propriétés acides des alcools.
6) Il y a complémentarité de cette manipulation avec celle du test de Lucas. Plus la liaison OH est réactive moins le
liaison CO l'est.
2) Selon Lewis
Synthèse de l’acétate d’isoamyle à partir du chlorure d’éthanoyle. expérience N°21 page 33
matériel: erlen 50 mL et de 25 mL; pipette pasteur ; cristallisoir ; ampoule à décanter ; bécher de 50 mL
produits: chlorure d’éthanoyle ; alcool isoamylique (3-méthylbutan-1-ol) ; Solution de Na2CO3 à 100 g.L-1 ; Na2SO4
anhydre. Réfractomètre.
Protocole: dans un erlen de 50 mL, refroidi dans un bain d’eau glacé, on verse 2 mL d’alcool isoamylique, puis goutte à
goutte 2,5 mL de chlorure d’éthanoyle.
Quand l’addition est terminé, verser le contenu de l’erlen dans l’ampoule à décanter contenant 30 mL d’une solution de
Na2CO3. Décanter l’ester obtenu (insoluble dans l’eau) et qui présente une odeur de banane. Le receuillir dans un erlen
de 25 mL contenant du Na2SO4 anhydre. Le produit obtenu pourra être identifier au réfractomètre.
remarque:
1) utiliser des gants et se placer sous la hotte.
2) la réaction entre le chlorure et l’alcool est très rapide et très exothermique
3) Connaître le mécanisme de l’estérification. L’estérification classique est athermique.
4) CO32- est une base qui va neutraliser l’acidité du milieu. Il apparaît un dégagement important de CO2, il faudra donc
dégazer plusieurs fois l’ampoule à décanter.
CO HCO
HCO CO O
3
23
3 2
+ H
+ H + H
+
+2
III Oxydation en phase gazeuse des alcools.

manip: lampe sans flamme
matériel: plaque chauffante, bécher de 250 ml, 1 entonnoir, tuyaux de caoutchouc, 2 ballon de Cloetz, trompe à eau
produit: éthanol, absolu, DNPH, Réactif de Schiff, glace
Propriétés réductrices des alcools.
Cette expérience est décrite dans de nombreux livre notamment ceux du secondaire (Chimie 1re S).
Chacun sait qu’un vin laissé à l’air tourne lentement au vinaigre. L’éthanol du vin est oxydé en acide acétique suivant la
réaction suivante:
CH3-CH2-OH + O2 CH3-COOH +H2O
Pour accélérer cette réaction, on peut opérer à chaud et en présence d’un catalyseur: le cuivre (ou le platine)
Verser dans le bécher environ 30 ml d’alcool, le tiédir afin que le bécher contienne des vapeurs d’alcool. Brancher la
pompe à eau. Porter au rouge le cuivre puis l’introduire rapidement dans le bécher en le suspendant dans les vapeurs de
l’alcool (le fil ne doit pas toucher l’alcool liquide mais être suspendu le plus proche possible du liquide).
Pour un alcool primaire:
R-CH2-OH + ½ O2 R-CHO + H2O
puis R-CHO + ½ O2 R-COOH
LA DNPH précipite (groupe carbonyle)
le réactif de Schiff devient rose. (aldéhyde)
Un papier pH placé dans les vapeurs montrera l’acidité du milieu (acide carboxylique)
On a donc l’aldéhyde et l’acide carboxylique.
Pour un alcool secondaire:
R-CHOH-R’ + ½ O2 R-CO-R’ +H2O
Seule la DNPH précipite (groupe carbonyle)
On a donc une cétone
Pour un alcool tertiaire: Rien
Remarque:
1) Le cuivre reste incandescent parce que la réaction d’oxydation est très exothermique.
2) Le réactif de Schiff doit être placé dans un bac à glace. En effet à température élevé le SO2 s’en va et le réactif vire au
rose tout seul. Rappelons que le réactif de Schiff est de la fuchsine décoloré par du dioxyde de Soufre.
3) ne pas utiliser un Bec Bunsen qui pourrait enflammé les vapeurs d’alcool.
4) l’entonnoir relié à la trompe à eau permet une aspiration des vapeurs d’aldéhydes (ou cétones) pour les tests, mais elle
sert aussi, par la dépression qu’elle cause à amener de l’oxygène dans le bécher.
5) On peut avoir une réaction secondaire entre le cuivre et l’oxygène.
6) Connaître la formule de la 2,4 DNPH.
Conclusion:
Ouverture possible sur la chimie industrielle, à condition d’avoir des connaissance sur ce sujet.
1
/
3
100%