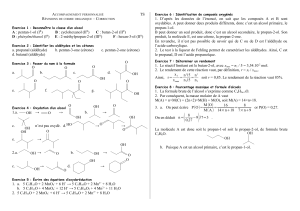
la reactivite des alcools

LA REACTIVITE DES ALCOOLS.
1. 3 CLASSES D’ALCOOLS.
alcool primaire
alcool secondaire
alcool tertiaire
..........................
ou .....................
............................
.............................
2. OXYDATION TOTALE PAR O2.
C’est une ................................
Lorsqu’elle est complète, les produits formés sont ..........................................
Ex : C2H5-OH + ..... O2 ...................................................
Remarque : L’oxydation est totale car la chaîne carbonée est ..............................
3. OXYDATION MENAGEE.
3.1. Cas des alcools primaires (voir TP).
- Lorsque l’oxydant est en défaut, un alcool primaire est oxydé en ......................................
.................................................................................................... (x ........) MnO4- / Mn2+
.................................................................................................... (x ........) R-CHO / R-CH2OH
...................................................................................................................................
- Lorsque l’oxydant est en excès, l’aldédyde formé est à son tour oxydé en .....................................................
En fait, tout se passe comme si l’alcool était directement oxydé en ............................................................
.................................................................................................... (x ........) MnO4- / Mn2+
.................................................................................................... (x ........) R-COOH / R-CH2OH
...................................................................................................................................
3.2. Cas des alcools secondaires.
Un alcool secondaire est toujours oxydé en ............................
.................................................................................................... (x ........) MnO4- / Mn2+
.................................................................................................... (x ........) R-CO-R’/ R-CHOH-R’
...................................................................................................................................

3.3. Cas des alcools tertiaires.
Aucun alcool tertiaire ne subit d’oxydation ménagée.
4. DESHYDRATATION.
H OH
R1-C-C-R4 .....................................................................
R2 R3
Tout alcool peut être déshydraté en ..........................
C’est un exemple de réaction d’élimination (ici de .................).
5. REACTIONS DE SUBSTITUTION.
Tout alcool peut être transformé en composé halogéné, par substitution du groupe hydroxyle ................
Ex : R-OH + HCl ...............................................................
R-OH + PCl5 ................................................................
6. INTERET INDUSTRIEL.
En raison de leur réactivité, les alcools permettent d’obtenir une grande variété de produits.
L’alcool, dont la production est la plus grande est le méthanol.
CH3Cl solvants...
CH3OH H-CHO résines, colles...
CH3-NH2 détergents...
substitution
chauffage
oxydation
substitution

LA REACTIVITE DES ALCOOLS.
1. 3 CLASSES D’ALCOOLS.
alcool primaire
alcool secondaire
alcool tertiaire
R-CH2OH
ou CH3-OH
R-CH-OH
R’
R’’
R-C-OH
R’
2. OXYDATION TOTALE PAR O2.
C’est une combustion.
Lorsqu’elle est complète, les produits formés sont CO2 et H2O.
Ex : C2H5-OH + 3 O2 2 CO2 + 3 H2O
Remarque : L’oxydation est totale car la chaîne carbonée est détruite.
3. OXYDATION MENAGEE.
3.1. Cas des alcools primaires (voir TP).
- Lorsque l’oxydant est en défaut, un alcool primaire est oxydé en aldéhyde.
Ex : MnO4- + 8 H+ + 5 e - = Mn2+ + 4 H2O (x 2) MnO4- / Mn2+
R-CH2OH = R-CHO + 2 H + + 2 e - (x 5) R-CHO / R-CH2OH
2 MnO4- + 6 H+ + 5 R-CH2OH 2 Mn2+ + 8 H2O + 5 R-CHO
- Lorsque l’oxydant est en excès, l’aldédyde formé est à son tour oxydé en acide carboxylique.
En fait, tout se passe comme si l’alcool était directement oxydé en acide carboxylique.
MnO4- + 8 H+ + 5 e - = Mn2+ + 4 H2O (x 4) MnO4- / Mn2+
R-CH2OH + H2O = R-COOH + 4 H + + 4 e - (x 5) R-COOH / R-CH2OH
4 MnO4- + 12 H+ + 5 R-CH2OH 4 Mn2+ + 11 H2O + 5 R-CHO
3.2. Cas des alcools secondaires.
Un alcool secondaire est toujours oxydé en cétone.
Ex : MnO4- + 8 H+ + 5 e - = Mn2+ + 4 H2O (x 2) MnO4- / Mn2+
R-CHOH-R’ = R-CO-R’ + 2 H + + 2 e - (x 5) R-CO-R’ / R-CHOH-R’
2 MnO4- + 6 H+ + 5 R-CHOH-R’ 2 Mn2+ + 8 H2O + 5 R-CO-R’

3.3. Cas des alcools tertiaires.
Aucun alcool tertiaire ne subit d’oxydation ménagée.
4. DESHYDRATATION.
H OH R1 R4
R1-C-C-R4 C=C + H2O
R2 R3 R2 R3
Tout alcool peut être déshydraté en alcène.
C’est un exemple de réaction d’élimination (ici de H2O).
5. REACTIONS DE SUBSTITUTION.
Par substitution du groupe hydroxyle –OH, un alcool peut être transformé en composé halogéné.
Ex : R-OH + HCl R-Cl + H2O
R-OH + PCl5 R-Cl + HCl + POCl3
6. INTERET INDUSTRIEL.
En raison de leur réactivité, les alcools permettent d’obtenir une grande variété de produits.
L’alcool, dont la production est la plus grande est le méthanol.
CH3Cl solvants...
CH3OH H-CHO résines, colles...
CH3-NH2 détergents...
substitution
chauffage
oxydation
substitution
1
/
4
100%