Chimie, Chapitre 10

- 1/7 -
Chimie, Chapitre 10 PREMIERE S
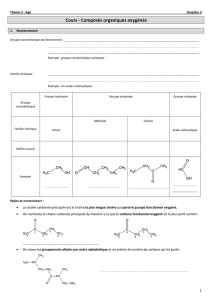
GROUPES CARACTERISTIQUES :
INITIATION A LA REACTIVITE
I – GROUPES D’ATOMES CARACTERISTIQUES
Un groupe caractéristique est un groupe d'atomes qui
confère des propriétés spécifiques aux molécules qui le
possèdent. On dit que ces molécules forment une famille
chimique.
Ces groupes d'atomes peuvent se réduire dans certains
cas à un seul atome. Voici quelques exemples d'atomes
ou de groupes d'atomes à connaître:
II - FAMILLE DES ACIDES CARBOXYLIQUES
1°) Nomenclature
Les molécules de cette famille présentent toutes le groupe carboxyle en bout de chaîne. On pourra les
noter R—COOH ou plus simplement R—CO2H.
On obtient leur nom en remplaçant le e final de l'alcane dont il dérive par la terminaison oïque et en le
faisant précéder du mot acide. On numérote la chaîne carbonée à partir du carbone fonctionnel (carbone
du groupe carboxyle).
Exemple:
2°) Réactivité
Les acides carboxyliques ont des propriétés oxydantes puisque faisant partie d’un couple rédox (cf.
§ sur la réactivité des alcools).
Les acides carboxyliques ont des propriétés acides puisque faisant partie d’un couple acido-
basique : acide carboxylique (R–COOH(aq)) / ion carboxylate (R–COO-(aq))
Exemple :
Réaction entre les ions hydroxyde (HO-(aq)) et l’acide éthanoïque (ou acide acétique) (CH3–COOH(aq)) :
Couple H2O(ℓ) / HO-(aq) :
Couple CH3–COOH(aq) / CH3–COO-(aq) :
Équation chimique :
Nom du groupe
Atome ou groupe d'atomes
carboxyle
amino
—NH2
halogéno
—X (F, Cl, Br, I)
carbonyle
hydroxyle
—OH

- 2/7 -
3°) Caractérisation
L'équation générale de la réaction d'un acide carboxylique avec l'eau s'écrit:
R—COOH + H2O R—COO- + H3O+
Le caractère acide est marqué par la présence d'ion oxonium H3O+ en solution aqueuse. La mise en
évidence expérimentale de ce caractère acide peut être faite à l'aide d'un pH-mètre (pH<7 à 25°C) ou plus
simplement à l'aide d'un indicateur coloré ou du papier pH (la solution devient jaune en présence de bleu
de bromothymol).
III - FAMILLE DES AMINES
1°) Nomenclature
Les molécules de cette famille présentent toutes un groupe amino fixé sur une chaîne carbonée. On pourra
les noter d'une façon générale R—NH2.
Leur nom officiel s'obtient en remplaçant le e final de l'alcane dont il dérive par le suffixe amine. Une
nomenclature plus courante (nomenclature usuelle ou nomenclature radicofonctionnelle) consiste à
ajouter le suffixe amine au nom du radical alkyle —R après en avoir élidé (supprimé) le e final.
Exemples :
2°) Réactivité
Les amines ont des propriétés basiques puisque faisant partie d’un couple acido-basique :
amine (R–NH2 (aq)) / ion alkylammonium primaire (R–NH3+(aq))
Exemple :
Réaction entre l’éthylamine (CH3–CH2–NH2(aq)) et l’acide éthanoïque (CH3–COOH(aq)) (ou acide
acétique) :
Couple CH3–CH2–NH3+(aq) / CH3–CH2–NH2(aq)) :
Couple CH3–COOH(aq) / CH3–COO-(aq) :
Équation chimique :
3°) Caractérisation
L'équation générale de la réaction d'une amine avec l'eau s'écrit:
R—NH2 + H2O R—NH3+ + HO-
Le caractère basique est marqué par la présence d'ions hydroxyde HO- en solution aqueuse. La mise en
évidence expérimentale de ce caractère basique peut être faite à l'aide d'un pH-mètre (pH>7 à 25°C) ou
plus simplement à l'aide d'un indicateur coloré ou du papier pH (la solution devient bleue en présence de
bleu de bromothymol).
IV – FAMILLES DES COMPOSES HALOGENES
1°) Nomenclature
Les molécules présentant un groupe halogéno font partie de la famille des composés halogénés. Si R
représente la chaîne carbonée, ces composés pourront être notés très généralement R—X (R—F pour les
composés fluorés, R—Cl pour les composés chlorés, R—Br pour les composés bromés et R—I pour les
composés iodés).
Leur nom s'obtient en faisant précéder le nom de l'alcane dont il dérive du préfixe fluoro, chloro, bromo
ou iodo, précédé de l'indice de position de ce groupe suivi d'un tiret.
Exemples :

- 3/7 -
2°) Réactivité
a) Passage du groupe halogéno au groupe amino –NH2
On passe d'une famille à l'autre par action de l'ammoniac NH3 sur le dérivé halogéné R—X.
R—X + NH3 R—NH2 + HX
mais l'amine obtenue est une base qui réagit avec l'acide HX suivant le bilan:
R—NH2 + HX R—NH3+ + X-
l'amine est alors obtenue par action de l'ammoniac en excès (réaction du type acide base)
R—NH3+ + NH3 R—NH2 + NH4+
l'équation de la réaction de ce passage est obtenue en faisant la somme des trois équations précédentes.
On a alors:
R—X + 2NH3 R—NH2 + NH4+ + X-
b) Passage d'un dérivé halogéné à l'alcool
Il peut se faire par action de l'eau sur le dérivé halogéné (on parle alors d'hydrolyse) ou mieux par action
des ions hydroxyde HO-. C'est une réaction qui présente peu d'intérêt industriel.
3°) Caractérisation
Les composés halogénés se caractérisent par la formation d'un précipité d'halogénure d'argent (qui noircit
à la lumière) lorsqu'on les traite avec une solution alcoolique de nitrate d'argent.
On peut le symboliser de la façon suivante:
V - FAMILLE DES COMPOSES CARBONYLES
1°) Nomenclature
On rencontre deux familles chimiques de composés présentant le groupe carbonyle :les aldéhydes et les
cétones
a) Famille des aldéhydes
Le groupe carbonyle est situé en bout de chaîne. On pourra les noter d'une façon générale R—CHO.
Leur nom s'obtient en remplaçant le e final de l'alcane dont il dérive par la terminaison al. La chaîne
carbonée d'un aldéhyde est numérotée à partir du carbone fonctionnel (le carbone du groupe carbonyle).
Exemples :
b) Famille des cétones
Le groupe carbonyle est situé dans la chaîne. On pourra les noter d'une façon générale R1—CO—R2.
Leur nom s'obtient en remplaçant le e final de l'alcane dont il dérive par la terminaison one précédée
éventuellement de l'indice de position du carbone fonctionnel (carbone du groupe carbonyle).
Exemple:

- 4/7 -
2°) Réactivité
a) Réactivité des aldéhydes
Les aldéhydes ont des propriétés oxydantes puisque faisant partie d’un couple rédox (cf. § sur la réactivité
des alcools).
b) Réactivité des cétones
Les cétones ont des propriétés oxydantes puisque faisant partie d’un couple rédox (cf. § sur la réactivité
des alcools).
3°) Caractérisation
a) Test commun aux aldéhydes et aux cétones.
Les composés carbonylés (aldéhydes et cétones) se caractérisent à l'aide de la 2,4-dinitrophénylhydrazine
(DNPH) avec laquelle ils donnent un précipité jaune-orangé de 2,4-dinitrophénylhydrazone.
b) Tests spécifiques des aldéhydes.
Liqueur de Fehling: Le chauffage modéré d'un mélange contenant de la liqueur de Fehling et un
aldéhyde conduit à un précipité rouge brique (constitué d'oxyde de cuivre (I) Cu2O).
Réactif de Tollens (solution de nitrate d'argent ammoniacal): Le chauffage modéré (50°C à 60°C au
bain marie) d'un mélange de réactif de Tollens et d''aldéhyde dans une verrerie très propre conduit à
la formation d'un miroir d'argent sur les parois de la verrerie.
Réactif de Schiff (fuschine décolorée par le dioxyde de soufre): A froid et en milieu non basique, en
présence d'un aldéhyde le réactif de Schiff prend une teinte rose- violacée.
VI - FAMILLE DES ALCOOLS
1°) Nomenclature
Les molécules de cette famille présentent toutes un groupe hydroxyle fixé sur une chaîne carbonée. On
pourra les noter d'une façon générale R—OH.
Leur nom s'obtient en remplaçant le e final du nom de l'alcane dont il dérive par le suffixe ol précédé de
l'indice de position du carbone fonctionnel (le carbone qui porte le groupe hydroxyle) encadré par deux
traits d'unions.
Exemples:
2°) Les trois classes d’alcool
Lorsque l'on observe la formule semi développée des alcools, on constate que l’atome de carbone porteur
du groupe hydroxyle –OH appelé atome de carbone fonctionnel est tétragonal et peut-être lié à zéro, un,
deux ou trois groupes alkyles R. Ce nombre de groupes alkyle permet de définir la classe d'un alcool.
Un alcool et dit :
primaire, si l’atome de carbone fonctionnel est lié à zéro ou un atome de carbone
secondaire, si l’atome de carbone fonctionnel est lié à deux atomes de carbone
tertiaire, si l'atome de carbone fonctionnel est lié à trois atomes de carbone

- 5/7 -
R
C
O
H
Classe de l’alcool
Formule générale
Exemples
primaire
R-CH2-OH
Ethanol
secondaire
Butan-2-ol
tertiaire
2-méthypropan-2-ol
3°) Réactivité
a) Oxydation non ménagée
Comme tous les composés organiques, les alcools peuvent subir l’action du dioxygène de l’air par
combustion.
Exemple : Combustion de l’éthanol :
b) Oxydation ménagée
L'oxydation ménagée d'un composé organique ne modifie pas la chaîne carbonée, mais uniquement le
groupe caractéristique de la molécule.
Oxydation ménagée des alcools primaires
Cas où l’oxydant est en défaut
Un alcool primaire et transformé en aldéhyde par action d'un oxydant introduit en défaut. Le couple
oxydant/réducteur intervenant dans cette réaction est R-CHO/R-CH2OH
Si la réaction se déroule en solution aqueuse, la demi équation associée à ce couple s'écrit :
+ 2H+ (aq) + 2e- = R-CH2-OH
Exemple :
Le butan-1-ol est transformé en butanal par action des ions permanganate en défaut, en milieu acide. En
combinant les deux demi équations pour que les nombres d'électrons cédés et captés soient égaux, on
obtient :
Cas où l’oxydant est en excès
Par action d'un oxydant introduit en excès, un alcool primaire et transformé en acide carboxylique. Le
couple oxydant/réducteur intervenant dans la réaction est R-COOH / R-CH2OH
En solution aqueuse, la demi équation de ce couple est :
(aq) + 4H+(aq) + 4e- = R-CH2-OH(aq) +H2O(l)
L'alcool est d'abord transformé en aldéhyde, puis l'aldéhyde est transformé en acide carboxylique.
CH
R
CH
R1
R2
OH
C
R1
R2
OH
R3
CH3
CH2
O
H
CH3
CH
OH
CH2
CH3
CH3
C
CH3
OH
CH3
R
C
O
OH
 6
6
 7
7
1
/
7
100%