les molécules de la beauté.

I.U.F.M. Lyon St.Etienne Préparation à l’Epreuve Orale sur Dossier
Octobre 2001
CHIMIE : les molécules de la beauté.
Sujet 1 : Les parfums
Documents fournis ou à consulter :
Extrait du programme de Terminale Scientifique ;
Ouvrages du secondaire et du supérieur ;
Exercice sur la synthèse de l’essence de jasmin.
Travail à effectuer :
Partie A : Exposé en relation avec les contenus scientifiques
Aperçu historique d’élaboration ; Composition d’un parfum ; Composition d’une crème de
beauté ; Isomérie et odeur ;
Elaboration par synthèse organique.
Partie B : En relation avec la situation d’enseignement
1°) Résoudre rapidement l’exercice ci-après :
L’éthanoate de phénylméthyle ou acétate de benzyle est l’un des constituants odorants de l’essence
de jasmin.
1- Ecrire l’équation de la réaction d’estérification permettant son obtention. Nommer l’acide A et
l’alcool B mis en jeu.
2- Lors d’une synthèse de cet ester E, on a utilisé 30,0 mL de A, 20,0 mL de B et obtenu 12g de E.
Calculer le rendement de cette synthèse.
3- Lorsqu’on coupe le chauffage à reflux, il reste nécessairement de l’acide A dans le mélange
réactionnel. Pourquoi ? Comment procède-t-on pour l’éliminer de la phase organique ? Ecrire
l’équation de la réaction alors mise en jeu.
4- Après séchage de la phase organique finale, celle-ci est analysée par chromatographie sur
couche mince à l’aide d’un éluant approprié. Dessiner le chromatogramme obtenu après
révélation. Quelle serait l’allure du graphe de la température en fonction du volume recueilli lors
d’une distillation fractionnée de cette phase organique ?
Données :
Composé
A
B
E
µ (g.cm-3)
1,049
1,042
1,056
t°eb (°C)
118
205
215
Rf
0,01
0,25
0,67
2°) Où le situer dans la progression ?
3°) Quels sont les objectifs et les prérequis ?
4°) Quelles sont les capacités évaluées ?
5°) Dans le cas où cet exercice sert à une évaluation, proposer un barème en rapport avec les
capacités évaluées.
6°) Commenter cet exercice (style des questions, questions inutiles ? questions manquantes ? …)

I.U.F.M. Lyon St.Etienne Préparation à l’Epreuve Orale sur Dossier
Octobre 2001
CHIMIE : les molécules de la beauté.
Sujet 2 : Extraction d’espèces chimiques - les arômes
Documents fournis ou à consulter :
Extrait du programme de seconde ;
Ouvrages du secondaire et du supérieur ;
Exercice de seconde.
Travail à effectuer :
Partie A : Exposé en relation avec les contenus scientifiques
Les techniques d’extraction ;
Caractérisation des espèces chimiques.
Partie B : En relation avec la situation d’enseignement en seconde.
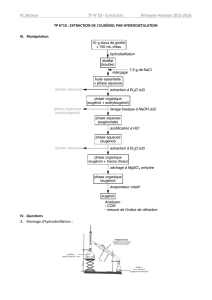
Soit l’exercice ci-après qui sert de thème à une séance de T.P.:
Le clou de girofle renferme un arôme appelé eugénol qu’on peut l’extraire par hydrodistillation. A
la fin de la manipulation, les phases organiques et aqueuses restent intimement mélangées. On
recherche donc à extraire l’eugénol du mélange.
Proposer une séance de TP avec un protocole expérimental guidé par des questions favorisant le
raisonnement des élèves.
- Expliciter toutes les étapes, en partant de clous de girofle jusqu’à l’obtention de
l’eugénol.
- Préciser les prérequis et les objectifs visés.
- Préciser le rôle du professeur et celui des élèves dans chaque étape. Préciser les
capacités mises en jeu.
- Préciser les consignes de sécurité.
Le tableau ci-après donne des informations concernant l’eugénol.
Température d’ébullition
253°C
Masse volumique
1,1 g.cm-3
Solubilité dans l’eau
Insoluble
Solubilité dans l’éthanol
Très soluble
Solubilité dans le dichlorométhane
Très soluble
Solubilité dans le chloroforme
soluble
La masse volumique du dichlorométhane est de 1,33 g.cm-3.
1
/
2
100%