Corrigé DE L`EUGÉNOL À LA VANILLINE

Corrigé DE L’EUGÉNOL À LA VANILLINE
1. Extraction de l’huile essentielle du clou de girofle
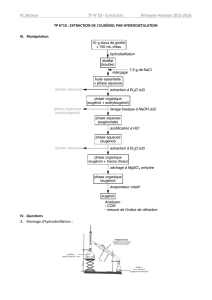
1.1. Le montage b est le montage d’hydrodistillation (le montage a est un chauffage à reflux, quant au
montage c il s’agit d’une ampoule à décanter).
1.2.1. Le dichlorométhane ayant une faible miscibilité avec l’eau, il ne se mélangera pas avec celle-ci.
On obtiendra un mélange hétérogène présentant deux phases. La phase aqueuse et la phase organique
(dichlorométhane).
1.2.2. La densité du dichlorométhane est de 1,34 ; elle est supérieure à celle de l’eau (d = 1). La phase
organique se retrouvera donc dans la phase inférieure.
1.2.3. L’eugénol étant très soluble dans le dichlorométhane et peu soluble dans l’eau, il se retrouvera dans
la phase organique.
1.2.4. L’eugénol possède une plus faible solubilité dans l’eau salée que dans l’eau. En ajoutant de l’eau
salée, on diminue fortement la quantité d’eugénol restante dans la phase aqueuse.
1.2.5. Pour réaliser une extraction par solvant, il faut que celui-ci soit non miscible à l’eau, et il faut que
l’espèce à extraire y soit plus soluble que dans l’eau.
L’éthanol n’est pas utilisable car miscible avec l’eau : on obtiendrait une seule phase.
Le cyclohexane convient, il est peu miscible avec l’eau (deux phases différentes) et l’eugénol est très
soluble dans le cyclohexane. Compte-tenu de sa densité, la phase organique se trouverait au-dessus
de la phase aqueuse.
1.3.1. Pour l’huile essentielle de giroflier (F), le chromatogramme ne présente pas
de tache à la même hauteur que celle de l’éthanoate d’eugényle (A).
Donc celle-ci ne contient pas d’éthanoate d’eugényle.
1.3.2. Pour l’huile essentielle de clous de girofle (H), le chromatogramme
présente deux taches situées respectivement à la même hauteur que l’eugénol(E)
et l’éthanoate d’eugényle (A).
L’huile essentielle de clous de girofle (H) contient deux espèces chimiques pures :
l’eugénol et l’éthanoate d’eugényle.
2. Sur le chemin de la vanilline
2.1.1. Le rôle du chauffage à reflux est d’accélérer la réaction (augmentation de la température) sans
perte de matière. Il évite ainsi le dégagement d’espèces nocives dans l’atmosphère.
2.1.2. L’utilisation d’un anhydride d’acide permet d’avoir une réaction rapide et totale, tandis qu’avec
un acide carboxylique la réaction d’estérification serait limitée.
2.1.3. L’éthanoate d’isoeugénol est insoluble dans l’eau glacée, il va donc précipiter. On pourra ainsi
le récupérer par filtration.
2.1.4. n(isoeugénol) = m
M n(isoeugénol) = ,50
164 = 3,0×10–2 mol
n(anhydride) = eau
d.ρ.V
mρ.V
=
MM M
= n(anhydride) = ,108 1 10
102
×
× = 0,11 mol
2.1.5. Le réactif limitant est l’isoeugénol, on pourra obtenir au maximum 3,0×10–2 mol d’éthanoate
d’isoeugénol.
m (éthanoate d’iso.) = n (isoeugénol)×M
m(éthanoate d’iso.) = 3,0×10–2×205 = 6,3 g (calcul effectué avec n(isoeugénol) non arrondie)
2.1.6. η= expérimentale
théorique
m
m η= 5, 6
6, 25 = 0,896 = 90%
2.2. Un catalyseur est une espèce chimique qui permet d’accélérer une réaction sans apparaitre dans
le bilan de la réaction, il ne modifie pas l’état final d’équilibre.

Corrigé Extraction du limonène et du citral dans l’écorce d’orange
1. Formules et groupes caractéristiques
1.1. Les liaisons doubles carbone-carbone sont responsables de la décoloration de l’eau de dibrome.
1.2. Le test à la liqueur de Fehling met en évidence l’appartenance du citral à la famille des aldéhydes.
groupe caractéristique carbonyle en bout de chaîne carbonée
2. Protocole expérimental
Montage 1 Montage 2 Montage 3
2.1. & 2.2.
Distillation fractionnée :
permet de séparer les
constituants d’un mélange.
Chauffage à reflux :
permet d’accélérer une
réaction sans perte de
matière.
Étape 1 : hydrodistillation :
les composés organiques présents
dans le zeste sont entraînés par la
vapeur d'eau.
2.3. L’étape 2 est appelée un relargage. Le limonène et le citral sont insolubles dans l’eau salée, ainsi ils
sont extraits de la phase aqueuse.
2.4. La phase organique constituée majoritairement de
dichlorométhane possède une densité proche de 1,3. Elle
possède une densité supérieure à l’eau salée (d = 1,1) ; ainsi
elle constitue la phase inférieure dans l’ampoule.
L’huile essentielle constituée essentiellement de citral et de
limonène, très solubles dans le dichlorométhane, est
présente dans la phase organique.
2.5. Le sulfate de magnésium anhydre permet d’éliminer
des traces d’eau éventuellement présentes dans la phase
organique
H3C C
CH CH2
CH
CH2 CH2
C
CH2
CH3
H3C CH CH2
CH2
O
C
CH3
C
CH3
C
H
CH
arrivée d’eau
sortie d’eau
phase
organique
p
hase a
q
ueuse

3. Identification
3.1.
3.2. Protocole de la chromatographie sur couche mince :
Sur le bas d’une plaque d’aluminium recouverte de gel de
silice, on trace au crayon à papier une ligne.
On dépose à l’aide de têtes d’épingles, quelques gouttelettes
des différentes espèces chimiques sur la ligne.
Éventuellement, on sèche les dépôts au sèche-cheveux.
On effectue à nouveau une série de dépôts.
Sous la hotte, dans une cuve à chromatographie, on verse un
fond d’éluant (mélange de cyclohexane et d’éther).
Le niveau de l’éluant ne doit pas atteindre la ligne de dépôt.
On place la plaque dans la cuve.
On laisse l’éluant monter, mais pas jusqu’en haut de la
plaque.
On retire la plaque, sous la hotte, on trace au crayon une
ligne marquant le front de l’éluant.
On sèche au sèche cheveux.
3.3. Le chromatogramme montre pour l’huile essentielle H, cinq taches. L’huile essentielle est un
mélange de cinq espèces chimiques. Deux taches sont situées respectivement à la même hauteur que la
tache du limonène et la tache du citral.
L’huile essentielle contient donc du limonène et du citral.
front du solvant
ligne de
dépôt
L H C B
A
1
/
3
100%