SPECIALITE 7 : extraction de l`eugénol du clou de

1
SPECIALITE 3 : extraction de l’eugénol du clou de girofle
Objectifs :
Apprendre à extraire une huile essentielle par hydrodistillation
Connaître le principe d'une extraction liquide-liquide
1. Propriétés de l’eugénol :
Les clous de girofle sont les boutons floraux séchés du giroflier,
un arbuste cultivé en Indonésie et en Afrique.
La molécule d’eugénol possède deux principales propriétés
biologiques : antiseptique et anesthésiante.
L’action antiseptique a été mise à profit très tôt et l’eugénol a
été préconisé en tant que traitement de la tuberculose et de la
gangrène pulmonaire.
C’est aussi une épice utilisée en cuisine, qui renferme une quantité importante d’une
substance grasse contenant des produits odorants appelée « huile essentielle » (environ
20% en masse), très riche en « eugénol » (environ80%).
OCH3
L’eugénol a pour formule semi-développée : CH2
CH
CH2
OH
Il possède de nombreuses propriétés médicinales et il est rapidement métabolisé et excrété
par l’organisme.
Sa température d’ébullition est de 253°C Sa température de fusion est de
9°C
Sa densité est de 1,06 et sa solubilité dans l’eau est négligeable, surtout dans l’eau salée.
Quel est l’état de l’eugénol à 100°C ? justifie.
Quel est l’aspect d’un mélange eugénol-eau ?
A partir de 10g de clous de girofle, quelle masse d’eugénol peut-on obtenir ?
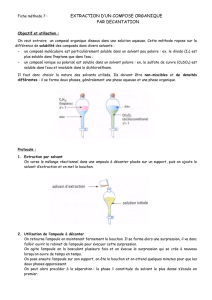
2. Extraction de l’huile essentielle du clou de girofle :
Pèse 10g de clous de girofle et réduis les en poudre.
Place les dans un ballon avec environ 250mL d’eau
distillée et quelques grains de pierre ponce.
Fais le schéma annoté du montage utilisé
pour effectuer cette hydrodistillation
Fais circuler l’eau dans le réfrigérant.
Porte lentement à ébullition.
Recueille le distillat dès que la température
devient constante et tant qu’elle le reste.
Quand la température recommence à varier, ne
recueille plus le distillat et arrête le chauffage.

2
Pourquoi faut-il toujours placer le chauffe-ballon sur un support élévateur ?
A quoi sert le réfrigérant ?
Par quelle entrée l’eau froide provenant du robinet doit-elle pénétrer dans le
réfrigérant ? justifie.
Quel est le rôle de la pierre ponce ?
Pourquoi faut-il arrêter le chauffage lorsque la température recommence à varier ?
Quel est l’aspect du distillat obtenu ?
3. Extraction liquide-liquide :
La solubilité d’un corps pur organique dans un solvant est liée à la structure de sa chaîne
carbonée et à ses groupes caractéristiques :
un composé ionique (ion éthanoate CH3CO2
,...) est soluble dans les solvants polaires tels
que l’eau ou l’alcool.
un composé polaire (comportant des liaisons C
O ou O
H,...) est soluble dans un solvant
polaire.
un composé apolaire (alcane, alcène,...) est soluble dans les solvants apolaires mais très
peu solubles dans les solvants polaires, surtout si des composés ioniques (NaCl) sont
dissous dans ce solvant.
Plus la chaîne carbonée est longue, plus la solubilité dans le solvant polaire est faible.
Ainsi, l’eugénol est très peu soluble dans l’eau mais très soluble dans le dichlorométhane
CH2Cl2.
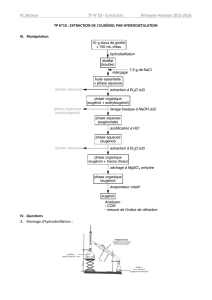
Ajoute une spatule de chlorure de sodium au distillat.
Agite et attends la dissolution du sel.
Verse le distillat dans l’ampoule à décanter, robinet fermé,
puis ajoute environ 30mL de dichloro-méthane (d=1,33).

3
Retourne l’ampoule en maintenant le bouchon d’une main.
Agite après avoir ouvert le robinet.
Referme le robinet puis replace l’ampoule dans son support.
Enlève le bouchon et laisse décanter quelques minutes.
Fais le schéma annoté ci-contre
Pourquoi a-t-on ajouté du chlorure de sodium dans le distillat ?
Cette étape s’appelle le relargage
Pourquoi faut-il ouvrir le robinet lorsqu’on agite le contenu de l’ampoule ?
Où se trouve le dichloro-méthane dans l’ampoule ? justifie ta réponse.
Enonce le principe d’une extraction liquide-liquide :
Récupère dans un bécher la phase organique puis rajoute à nouveau à la phase aqueuse,
dans l’ampoule à décanter, environ 30mL de dichloro-méthane.
Agite puis laisse reposer comme précédemment, et récupère la nouvelle phase organique
que tu rajoutes à la précédente.
Quel est l’intérêt d’avoir effectué une extraction en deux étapes ?
La phase organique contient les deux constituants de l’huile essentielle : l’eugénol, dont le
groupe caractéristique phénol possède des propriétés acides, et l’acétyleugénol.
H

4
4. Séparation de l’eugénol et de l’acétyleugénol :
Verse dans l’ampoule à décanter vide la phase organique récupérée précédemment puis
ajoute 30mL de solution de soude à 2,0 mol.L
1.
Agite, laisse décanter, puis récupère la phase aqueuse dans un bécher propre.
Ecris l’équation chimique modélisant la transformation de la fonction phénol de l’eugénol
en ion eugénate.
Que contient la phase aqueuse? justifie.
Rajoute dans cette phase aqueuse une solution d’acide chlorhydrique à 2,0 mol.L
1
jusqu’à obtenir un pH acide, contrôlé au papier pH.
Ecris l’équation de la réaction chimique que tu réalises ainsi :
Utilise l’ampoule à décanter pour extraire en deux étapes la phase organique avec 30mL
de dichloro-méthane à chaque étape.
En fin d’extraction, il est souvent utile d’éliminer des substances , autres que l’espèce à
extraire (ici l’eugénol) dissoutes également dans le solvant organique.
On effectue alors un lavage de cette phase organique, avec de l’eau, dans l’ampoule à
décanter.
Lave la phase organique à l’eau puis sèche là avec un peu de sulfate de magnésium
anhydre... le produit final obtenu est l’eugénol !
1
/
4
100%