2007

Travaux pratique de chimie organique 30-31 Mai 2007
Croset Elliott
TP6 : Réaction des aldéhydes
et des cétones
I. But :
Une molécule présente dans les clous de girofle est l’eugénol. Nous allons d’abord extraire
l’huile essentielle du clou de girofle pour distillation, puis nous allons séparer les deux
principaux composés de l’huile essentielle, l’eugénol et l’acétyleugénol.
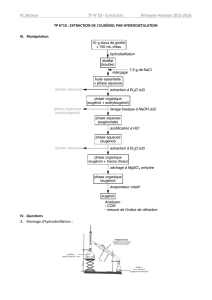
II. Partie expérimentale :
Pour extraire l’huile essentielles des clous de girofle, nous allons utiliser le fait que l’eau et
cette huile forme forment un azéotrope. Cette propriété vas nous permettre de distiller l’huile
essentielle à un température beaucoup plus basse que sont point d’ébullition (on distille à
100°C au lieu de 255°C). Nous distillons d’abord donc un mélange de 100mL d’eau et de
25g de clous de girofle. Lors que le volume d’eau dans le ballon de chauffage devient
insuffisant, nous rajoutons 60mL d’eau et nous recueillons la seconde partie du distillat. On
constate déjà que l’eugénol n’est pas bien soluble dans l’eau. Nous allons donc l’extraire
avec du dichlorométhane. Nous extrayons l’huile essentielle en trois fois. En effet nous
avons déjà vu que les extractions multiples sont plus efficaces que les simples. Nous avons
donc maintenant une phase organique contenant la majorité de l’huile essentielle contenus
dans les cous de girofle initiale.
1

Nous séparons alors maintenant les deux composant principale de l’huile essentielle,
l’eugénol et l’acétyleugénol :
OH
OCH
3
CH
2
CH CH
2
O
OCH
3
CH
2
CH CH
2
CH
3
O
Eugénol Acétyleugénol
Nous allons les séparer par extraction. Pour cela, nous ajoutons une base forte au
mélange (NaOH) pour déprotoner la fonction alcool de l’eugénol et le rendre ainsi
soluble dans la phase aqueuse. L’extraction se fait toujours par trois ajouts de
soude. Nous pouvons alors éliminé la phase organique et évaporer le solvant,
après avoir séché la phase. On peu alors extraire l’eugénol de la phase aqueuse
en la reprotonant avec un acide fort, comme de l’acide chlorhydrique. On à donc
de l’eugénol peu soluble dans l’eau, que l’on extraira facilement avec du
dichlorométhane. On évapore le solvant après avoir séché la phase. On peu alors
peser les masses obtenues. L’eugénol est sous forme d’huile à la fin de
l’évaporation et l’acétyleugénol sous forme de cristaux.
m(eugénol) = 0.7g
m(acétyleugénol) = 1.6g
m(initiale) = 12.5g
Pourcentage d’huile = (0.7+1.6)/12.5 = 18.4%
Pourcentage d’huile théorique = 14-20%
Rendement = 18.4/20 = 92%
III. Commentaires et discussions :
Le rendement de l’extraction est exactement dans les valeurs décrites par la littérature. Tout
de fois l’acétyleugénol obtenus doit contenir une partie l’eugénol vu que c’est normalement
l’eugénol et non l’acétyleugénol qui est majoritaire dans l’huile essentielle.
2
1
/
2
100%