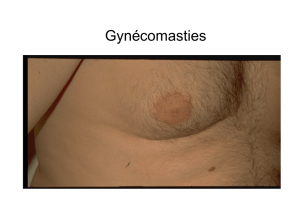
Télécharger le document au format PDF

La gynécomastie correspond à une hyperplasie non tumorale de
la glande mammaire. Elle touche généralement les deux seins,
mais peut cependant être unitalérale. Ce qui peut paraître para-
doxal, surtout lorsqu’une étiologie endocrinienne doit être rete-
nue, s’explique vraisemblablement par des différences de sensi-
bilité des récepteurs présents au niveau du tissu mammaire [5,
19, 26].
Le mode de découverte est très variable. Il peut s’agir d’une
découverte fortuite à l’examen clinique ou au contraire du motif
même de la consultation en raison de son volume ou d’une gêne,
voire d’une douleur.
En période néonatale la gynécomastie est fréquente et s’ex-
plique par le passage transplacentaire des œstrogènes. Sa surve-
nue possible à la puberté correspond à l’initiation de la stéroï-
dogenèse. Chez l’homme plus âgé il existe un pic de fréquence
entre 50 et 80 ans où les trois quarts de la population sont tou-
chés. L’origine de ces gynécomasties est souvent mixte mais le
déficit androgénique est la cause la plus fréquente chez l’hom-
me âgé.
I. ANATOMO-PATHOLOGIE
Il s’agit d’une prolifération galactophorique et conjonctive de
type œstrogénique, sans acini, mais avec ébauche de pseudo-
lobules. La proportion entre tissu épithélial et tissu conjonctif
dépend de l’ancienneté de la gynécomastie.Trois types anato-
mopathologiques sont décrits dans la classification de Williams
[24, 28]:
-Le type 1 correspond à un aspect floride, assez typique de
l’œstrogénothérapie. L’hyperplasie des canaux est entourée de
façon concentrique par un conjonctif assez lâche et oedémateux
où les fibres collagènes sont rares. L’épithélium est hyperpla-
sique.
-Le type 2 montre un aspect quiescent. C’est le type le plus fré-
quent. Les canaux sont enchâssés dans un collagène dense, sans
hyperplasie épithéliale (Figure 1).
-Le type 3 est d’aspect dissocié. C’est le plus rare. Il existe une
hyperplasie épithéliale des canaux mais le collagène est dense.
Progrès en Urologie (2004), 14, 685-688
Androgènes, vieillissement masculin et gynécomastie
J.L. PARIENTE1,J.TOSTAIN, D.ROSSI
1Service d’Urologie, CHU de Bordeaux
686
◆Physiologie des Androgènes :
de l’Homme Adulte à l’Homme Vieillissant
Figure 1 : Gynécomastie de type 2 : Prolifération galactophorique et
conjonctive avec des pseudo-lobules entourés de façon concentrique
par un conjonctif assez dense (HESx25)

II. PHYSIOPATHOLOGIE
L’apparition d’une gynécomastie traduit une modification du
rapport œstrogène /testostérone. En effet, les androgènes, la tes-
tostérone ou la dihydrotestostérone sont inhibiteurs de la proli-
fération du tissu mammaire. Les œstrogènes endogènes, exogè-
nes ou provenant de l’aromatisation des androgènes stimulent
aucontraire la prolifération du tissu mammaire. Les cellules de
Leydig secrètent 15% de l’oestradiol circulant. Le reste provient
de la conversion extragonadique d’un précurseur androgénique.
Il en va de même pour l’œstrone avec un rapport 5% testiculai-
re - 95% extragonadique.
L’hyperœstrogénie peut être absolue s’il existe une augmenta-
tion pathologique des secrétions d’œstrogènes d’origine tumo-
rale, leydigienne (stimulées par l’hCG) ou périphérique par aro-
matisation au niveau du tissu adipeux. Il peut s’agir également
d’œstrogènes d’origine exogène (médicaments, aliments). La
synthèse de la SHBG est alors augmentée et entraîne une réduc-
tion supplémentaire de la fraction libre des androgènes ce qui
majore encore l’ambiance œstrogénique [13].
L’hyperœstrogénie peut être relative s’il existe une diminution
des androgènes plasmatiques par rapport à des sécrétions d’œs-
trogènes qui restent normales. L’affinité de la SHBG étant plus
grande pour les androgènes que pour les œstrogènes, la fraction
libre des androgènes se trouve encore plus diminuée.
Enfin il existe de nombreuses hormones régulatrices de l’équili-
bre androgènes/œstrogènes comme les hormones thyroïdiennes,
le cortisol, la prolactine, les gonadotrophines hypophysaires,
l’hCG, l’hormone de croissance et l’insuline [27]. Le déficit
« multihormonal » lié à l’âge est là encore au premier plan.
III. ASPECT CLINIQUE
L’interrogatoire oriente le diagnostic. Il faut rechercher des
antécédents familiaux du même type, des manifestations sem-
blables à la puberté. L’examen clinique permet de préciser le
caractère uni ou bilatéral, la symétrie éventuelle de la gynéco-
mastie et le volume de la tuméfaction. La palpation recherche
également un écoulement mamelonnaire et d’éventuelles adéno-
pathies axillaires.
Le principal diagnostic différentiel à évoquer est l’adipomastie,
de consistance plus molle, granuleuse, non centrée par le mame-
lon, qui a tendance à suivre le bord inféro-externe du muscle
grand pectoral et est souvent associée à une surcharge pondéra-
le. Les tumeurs du sein sont rares chez l’homme, mais il faut
savoir évoquer le diagnostic devant un nodule dur, insensible,
s’accompagnant d’un éventuel écoulement.
L’examen clinique doit être complété en étudiant les caractères
sexuels secondaires, en examinant en particulier les testicules à
la recherche d’un nodule suspect, la thyroïde, et le foie. Les au-
tres signes classiques d’hypoandrogénie liée à l’âge seront
recherchés.
Des examens complémentaires peuvent être utiles : une mam-
mographie [9] et/ou une échographie mammaire permettent de
mieux préciser les caractères perçus lors de l’examen clinique et
de confirmer le diagnostic de gynécomastie. La radiographie
pulmonaire permet d’éliminer une tumeur broncho-pulmonaire.
Le bilan hormonal doit être complet : FSH, LH, prolactine,
œstradiol, testostérone totale et biodisponible (ou calculée), β-
hCG et SHBG. En fonction des résultats, un complément orien-
té peut être demandé (échographie testiculaire, bilan thyroïdien,
hépatique ou surrénalien).
IV. ETIOLOGIES
Les gynécomasties sont le plus souvent liées à un déséquilibre
hormonal. Chez l’homme âgé une cause iatrogène doit être
recherchée en priorité mais il s’agit le plus souvent d’une gyné-
comastie liée à un hypogonadisme. La liste suivante tente de
recenser les causes iatrogènes de la façon la plus complète pos-
sible, même si certains des traitements cités ne sont pas utilisés
très fréquemment chez l’homme âgé.
1- Etiologies iatrogènes
Après l’hypogonadisme, c’est la cause la plus fréquente de
gynécomastie chez l’homme âgé. La liste des médicaments
potentiellement responsables est assez longue :
•Les œstrogènes, utilisés par le patient pour traiter un cancer
de prostate ou par sa partenaire en gel percutané qui peut être
absorbé lors d’un contact direct peu de temps après applica-
tion.
•Les androgènes par augmentation de la conversion périphé-
rique.
•Les anti-androgènes (acétate de cyprotérone, flutamide, kéto-
conazole, spironolactone, cimétidine) ou certains toxiques
pouvant avoir des propriétés anti-androgènes (haschich,
marijuana),
•Les agonistes du GnRh,
•Les inhibiteurs de la 5 réductase (finastéride, dutastéride) [7],
•Les œstrogéno-mimétiques (digoxine, amiodarone, antical-
ciques, isoniazide),
•Les anti-dopaminergiques (sulpiride, métoclopramide, tiapri-
de, phénothiazine, risperidone),
•La chimiothérapie anti-néoplasique [3],
•Les inhibiteurs de l’urico-synthèse (allopurinol) [22],
•Les traitements anti HIV :antiprotéases (indinavir), et inhi-
biteurs de la reverse transcriptase (stavudine) [6, 20]
2- Etiologies gonadiques
Elles sont plus rares chez l’homme âgé.
•Tumeurs à cellules de Leydig (hypersécrétion d’œstrogènes)
[11, 21]
•Tumeurs germinales (hypersécrétion d’HCG) [3],
•Tumeurs à cellules de Sertoli (hyper aromatisation des andro-
gènes),
•Hypogonadismes congénitaux ou acquis (syndrome de Kli-
nefelter,traumatisme, torsion, radiothérapie, chimiothéra-
pie),
687

•Pseudo-hermaphrodisme (déficit enzymatique),
•Syndrome de résistance aux androgènes
3- Etiologies tumorales extra-génitales
Elles doivent faire l’objet d’une attention toute particulière chez
l’homme âgé.
•Surrénaliennes (hypersécrétion d’œstrogènes et/ou d’andros-
tènedione),
•Bronchiques (carcinome épidermoïde),
•Hépatiques (hépatocarcinome)
•Rénales, cérébrales,
•Adénome hypophysaire à prolactine.
4- Etiologies métaboliques
Elles sont fréquentes et souvent intriquées au DALA.
•Alcoolisme et cirrhose (élévation de la SHBG et de l’œstra-
diol libre avec abaissement de la testostérone libre) [15, 17,
29],
•Dénutrition sévère,
•Insuffisance rénale,
•Hyperthyroïdie (élévation de la SHBG) [12].
5- Etiologies diverses
•Hyperstimulation du mamelon (sexuelle, névrotique ou
mécanique),
•Idiopathiques
V.EVOLUTION
Les gynécomasties peuvent quelquefois disparaître spontané-
ment, mais le plus souvent l’évolution varie selon l’étiologie.
Cependant, si le degré de fibrose est important (surtout quand la
gynécomastie est ancienne), la régression ne sera pas obtenue
malgré la suppression de la cause et l’éventuel traitement sub-
stitutif androgénique.
Les différentes complications connues en pathologie mammaire
chez la femme peuvent survenir, à savoir des kystes, des fibro-
adénomes ou une inflammation locale. La dégénérescence est
exceptionnelle sauf chez le patient porteur d’un syndrome de
Klinefelter.
VI. TRAITEMENT
Le traitement médical est assez décevant. On peut utiliser selon
les étiologies une androgénothérapie percutanée par un compo-
sé non aromatisable (notamment androstanolone en gel trans-
dermique), du tamoxifène, du danazol, ou de la bromocriptine
[4, 14-16].
Chez les patients traités pour un cancer de la prostate on peut
tenter un changement d’anti-androgène sans en attendre un
résultat parfait. Certains auteurs ont pu proposer une radiothéra-
pie localisée préventive, ce qui paraît excessif [14].
Le traitement chirurgical s’adresse aux patients présentant des
complications où chez qui la persistance d’une gynécomastie est
gênante sur le plan esthétique (plutôt chez le sujet jeune). Ce
traitement chirurgical ne résout pas le problème étiologique.
Sur le plan technique deux types d’interventions peuvent être
proposées. La plus classique est une mastectomie sous-cutanée
réalisée par une incision péri-aréolaire avec correction d’un
éventuel excès de peau [8, 18, 23, 25]. La complication la plus
fréquente est une invagination du mamelon. La seconde est
représentée par des techniques d’aspiration sur le modèle de la
liposuccion [1, 2, 10] par micro incision para-aréolaire ou par
incision axillaire.
VII. CONCLUSION
La fréquence de la gynécomastie croît avec l’âge. L’augmen-
tation du volume mammaire ne suffit pas pour porter le dia-
gnostic de gynécomastie. Un bilan étiologique précis doit
être réalisé et le traitement dépend du contexte. Chez l’hom-
me âgé l’hypogonadisme et les causes iatrogènes sont les
étiologies les plus fréquentes.
REFERENCES
1. ABRAMO A.C.: Axillary approach for gynecomastia liposuction. Aesthetic
Plast Surg, 1994, 18, 265-268.
2. ABRAMO A.C., VIOLA J.C.: Liposuction through an axillary incision for
treatment of gynecomastia. Aesthetic Plast Surg, 1989, 13, 85-89.
3. AKI F.T., TEKIN M.I., OZEN H.: Gynecomastia as a complication of
chemotherapy for testicular germ cell tumors. Urology, 1996, 48, 944-946.
4. BOWERS S.P., PEARLMAN N.W., MCINTYRE R.C., JR., FINLAYSON
C.A., HUERD S.: Cost-effective management of gynecomastia. Am J Surg,
1998, 176, 638-641.
5. BRAUNSTEIN G.D.: Gynecomastia. N Engl J Med, 1993, 328, 490-495.
6. CAEIRO J.P., VISNEGARWALA F., RODRIGUEZ-BARRADAS M.C.:
Gynecomastia associated with indinavir therapy. Clin Infect Dis, 1998, 27,
1539-1540.
7. CARLIN B.I., SEFTEL A.D., RESNICK M.I., FINDLAY J.: Finasteride
induced gynecomastia. J Urol, 1997, 158, 547.
8. CASANOVA D., MAGALON G.: [Surgical treatment of gynecomastia]. J
Chir (Paris), 1997, 134, 76-79.
9. CHANTRA P.K., SO G.J., WOLLMAN J.S., BASSETT L.W.: Mammogra-
phy of the male breast. AJR Am J Roentgenol, 1995, 164, 853-858.
10. DOLSKY R.L.: Gynecomastia. Treatment by liposuction subcutaneous
mastectomy. Dermatol Clin, 1990, 8, 469-478.
11. GANA B.M., WINDSOR P.M., LANG S., MACINTYRE J., BAXBY K.:
Leydig cell tumour. Br J Urol, 1995, 75, 676-678.
12. HO H.K., LOH K.C.: Hyperthyroidism with gynaecomastia as the initial
complaint: a case report. Ann Acad Med Singapore, 1998, 27, 594-596.
13. KUHN J., SIBERT L.: Les pathologies du vieillissement masculin. Mon-
trouge, F, John Libbey Eurotext, 2002, 165p.
14. LEMACK G.E., POPPAS D.P., VAUGHAN E.D., JR.: Urologic causes of
gynecomastia: approach to diagnosis and management. Urology, 1995, 45,
313-319.
15. MARTINEZ-RIERA A., SANTOLARIA-FERNANDEZ F., GONZALEZ
REIMERS E., MILENA A., GOMEZ-SIRVENT J.L., RODRIGUEZ-
MORENO F., GONZALEZ-MARTIN I., RODRIGUEZ-RODRIGUEZ E.:
Alcoholic hypogonadism: hormonal response to clomiphene. Alcohol,
1995, 12, 581-587.
16. MATHUR R., BRAUNSTEIN G.D.: Gynecomastia: pathomechanisms and
treatment strategies. Horm Res, 1997, 48, 95-102.
17. MOTOO Y., TAGA H., SU S.B., SAWABU N.: Effect of gegen-tang on
688

painful gynecomastia in patients with liver cirrhosis: a brief report. Am J
Chin Med, 1997, 25, 317-324.
18. PARK A.J., LAMBERTY B.G.: Gynaecomastia: have Webster’s lessons
been ignored? J R Coll Surg Edinb, 1998, 43, 89-92.
19. PONS J.: Pathologie du sein masculin. In: Andrologie. Arvis G., ed. Paris,
Maloine, 1987 (vol 1).
20. SCHURMANN D., BERGMANN F., EHRENSTEIN T., PADBERG J.:
Gynaecomastia in a male patient during protease inhibitor treatment for
acute HIV disease. Aids, 1998, 12, 2232-2233.
21. SCIARRA A., CASALE P., DI NICOLAS S., SI CHIRO C., DI SILVERIO
F.: Hormonal profile of patients with Leydig cell tumors: a urologic cause
of gynecomastia. Minerva Urol Nefrol, 1998, 50, 241-246.
22. SEIBEL V., MULLER H.H., KRAUSE W.: [Incidence of gynecomastia in
dermatology patients]. Hautarzt, 1998, 49, 382-387.
23. SMOOT E.C., 3RD: Eccentric skin resection and purse-string closure for
skin reduction with mastectomy for gynecomastia. Ann Plast Surg, 1998,
41, 378-383.
24. TROJANI M.: Atlas d’histopathologie mammaire. Paris, Maloine, 1988.
25. VASSEUR C., MARTINOT V., HODIN E., PATENOTRE P., PELLERIN
P.: [Gynecomastia. Management of diagnosis and therapy. Apropos of 52
cases]. Ann Chir, 1998, 52, 146-157.
26. WEBSTER D.J.: Benign disorders of the male breast. World J Surg, 1989,
13, 726-730.
27. WILLIAMS G.M.: Gynecomastia. N Engl J Med, 1993, 329, 209.
28. WILLIAMS M.J.: Gynecomastia. Its incidence, recognition and host cha-
racterization in 447 autopsy cases. Am J Med, 1963, 34, 103-112.
29. YOSHITSUGU M., IHORI M.: [Endocrine disturbances in liver cirrhosis—
focused on sex hormones]. Nippon Rinsho, 1997, 55, 3002-3006.
689
1
/
4
100%